| 配合物理论 题目答案及解析
稿件来源:高途
| 配合物理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
配合物理论
金属镓在电子工业、生物医学等多个领域有广泛应用。利用锌粉置换渣$\rm ($主要成分为$\rm Ga_{2}S_{3}$、$\rm Ga_{2}O_{3}$和少量的$\rm ZnS$、$\rm FeO$、$\rm Fe_{2}O_{3}$、$\rm SiO_{2}$等$\rm )$制备镓的工艺流程如图所示:
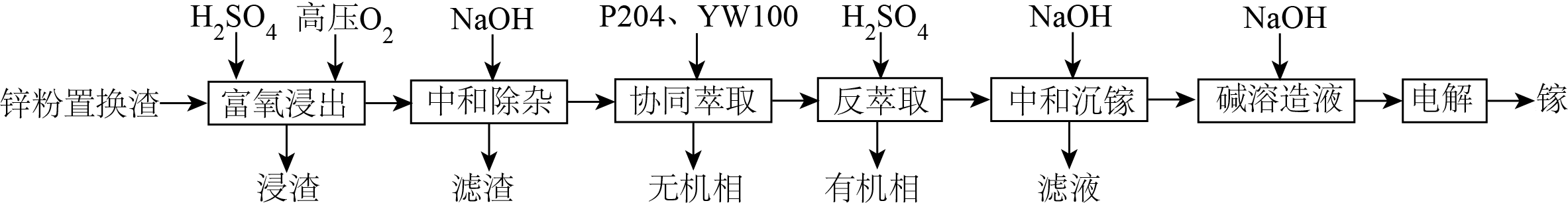
已知:$\rm I$.溶液中相关离子开始沉淀和沉淀完全$(c\le 1.0\times {{10}^{-5}}\,\text{mol}\cdot {{\text{L}}^{-1}}\rm )$时的$\rm pH$:
| 物质 | $\rm Fe^{3+}$ | $\rm Fe^{2+}$ | $\rm Zn^{2+}$ | $\rm Ga^{3+}$ |
| 开始沉淀的$\rm pH$ | $\rm 1.9$ | $\rm 6.9$ | $\rm 6.2$ | $\rm 3.2$ |
| 沉淀完全时的$\rm pH$ | $\rm 3.2$ | $\rm 8.4$ | $\rm 8.0$ | $\rm -$ |
Ⅱ. $\rm P204$、$\rm YW100$协同萃取体系对金属离子的优先萃取顺序为:$\rm Fe^{3+}\gt Ga^{3+}\gt Fe^{2+}\gt Zn^{2+}$
回答下列问题:
元素$\rm Ga$在元素周期表中的位置是 。
第四周期$\\rm IIIA$族
"]]已知$\rm Ga$是$\rm 31$号元素,其核外电子排布式为:$\rm 1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}3d^{10}4s^{2}4p^{1}$,则元素$\rm Ga$在元素周期表中的位置是第四周期$\rm IIIA$族;
“富氧浸出”中溶液出现淡黄色浑浊,写出$\rm Ga_{2}S_{3}$发生反应的离子方程式为 。
$\\rm 2Ga_{2}S_{3}+3O_{2}+12H^{+}=4Ga^{3+}+6S+6H_{2}O$
"]]由分析可知,“富氧浸出”中溶液出现淡黄色浑浊,即产生$\rm S$沉淀,故$\rm Ga_{2}S_{3}$发生反应的离子方程式为:$\rm 2Ga_{2}S_{3}+3O_{2}+12H^{+}=4Ga^{3+}+6S+6H_{2}O$;
滤渣的主要成分是 $\rm ($写化学式$\rm )$。
$\\rm Fe(OH)_{3}$
"]]由分析可知,滤渣的主要成分是$\rm Fe(OH)_{3}$;
用$\rm H_{2}A_{2}$代表$\rm P204$,$\rm RH$代表$\rm YW100$,“协同萃取”过程中发生反应:$\text{G}{{\text{a}}^{3+}}+{{\text{H}}_{2}}{{\text{A}}_{2}}+2\text{RH}\rightleftharpoons \text{Ga}(\text{H}{{\text{A}}_{2}}){{\text{R}}_{2}}+3{{\text{H}}^{+}}$,“协同萃取”的作用是 ,“反萃取”加入稀硫酸的目的是 $\rm ($用化学方程式表示$\rm )$。
$\\rm Zn^{2+}$进入无机相,使$\\rm Ga^{3+}$和$\\rm Zn^{2+}$分离,除去$\\rm Zn^{2+}$ ; $\\rm 2Ga(HA_{2})R_{2}+3H_{2}SO_{4}=Ga_{2}(SO_{4})_{3}+4RH+2H_{2}A_{2}$
"]]根据已知信息,$\rm Ga^{3+}$比$\rm Zn^{2+}$优先被萃取至$\rm P204$、$\rm YW100$协同的有机相中,即“协同萃取”过程,镓元素以$\rm Ga(HA_{2})R_{2}$形式被萃取至有机相中,$\rm Zn^{2+}$进入无机相,从而分离$\rm Ga^{3+}$和$\rm Zn^{2+}$,则“协同萃取”的作用是:$\rm Zn^{2+}$进入无机相,使$\rm Ga^{3+}$和$\rm Zn^{2+}$分离,除去$\rm Zn^{2+}$,“反萃取”时加入稀硫酸,溶液$\rm c(H^{+})$增大,萃取反应逆向移动,将以$\rm Ga(HA_{2})R_{2}$形式存在的$\rm Ga$元素转化为$\rm Ga^{3+}$,则“反萃取”加入稀硫酸的目的是$\rm ($用化学方程式表示$\rm )$:$\rm 2Ga(HA_{2})R_{2}+3H_{2}SO_{4}=Ga_{2}(SO_{4})_{3}+4RH+2H_{2}A_{2}$;
“碱溶造液”中产生了${{\left[ \text{Ga}{{(\text{OH})}_{4}} \right]}^{-}}$离子,该离子中含有的化学键类型有 $\rm ($填序号$\rm )$。
$\rm a$.极性共价键 $\rm b$.非极性共价键 $\rm c$.配位键 $\rm d$.氢键 $\rm e$.离子键
$\\rm ac$
"]]“碱溶造液”中产生了${{\left[ \text{Ga}{{(\text{OH})}_{4}} \right]}^{-}}$离子,该离子中含有$\rm O-H$极性共价键和$\rm Ga$与$\rm O$之间的配位键,不存在非极性键和离子键,氢键不属于化学键;
“电解”生成镓的过程中阴极的电极反应式为 。
${{\\left[ \\text{Ga}{{(\\text{OH})}_{4}} \\right]}^{-}}+3{{\\text{e}}^{-}}=\\text{Ga}+4\\text{O}{{\\text{H}}^{-}}$
"]]“碱溶造液”中产生了${{\left[ \text{Ga}{{(\text{OH})}_{4}} \right]}^{-}}$,“电解”生成镓的过程中阴极上${{\left[ \text{Ga}{{(\text{OH})}_{4}} \right]}^{-}}$被还原生成$\rm Ga$,其电极反应式为:${{\left[ \text{Ga}{{(\text{OH})}_{4}} \right]}^{-}}+3{{\text{e}}^{-}}=\text{Ga}+4\text{O}{{\text{H}}^{-}}$。
| 配合物理论题目答案及解析(完整版)
