| 杂化轨道理论 题目答案及解析
稿件来源:高途
| 杂化轨道理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
杂化轨道理论
近年来,科学家利用电化学催化的方法,将$\rm PET$塑料(聚对苯二甲酸乙二酯)水解液中的乙二醇($\rm HOC{{H}_{2}}C{{H}_{2}}OH$)和温室气体$\rm C{{O}_{2}}$转化为甲酸$\rm (HCOOH)$,原理如图所示。下列说法错误的是$\rm (\qquad)$
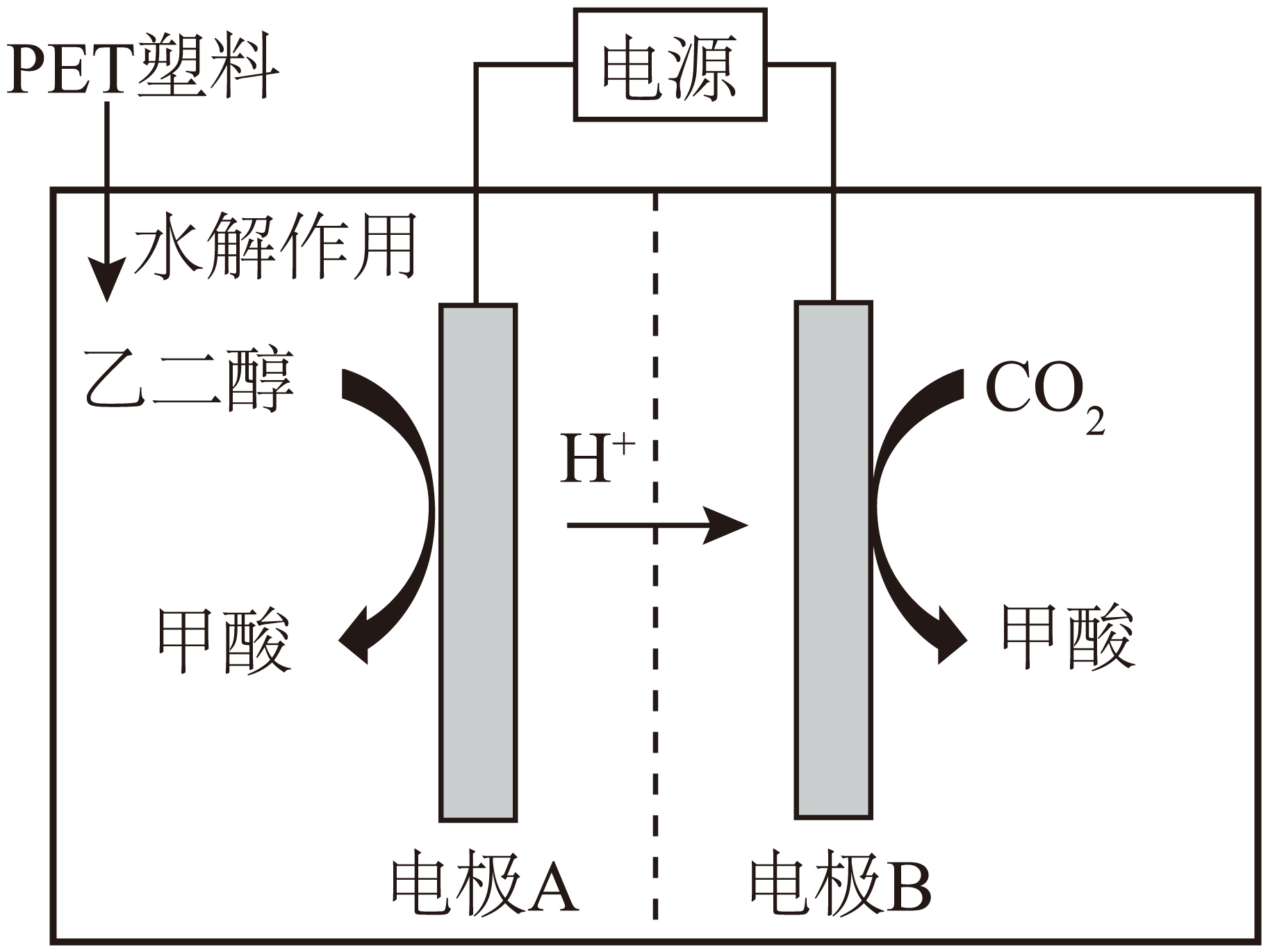
电极$\\rm A$与电源正极相连
","电极$\\rm B$的反应:$\\rm C{{O}_{2}}+2{{e}^{-}}+2{{H}^{+}}=HCOOH$
","$\\rm 1$ $\\rm mol$乙二醇参加反应两极共生成$\\rm 3$ $\\rm mol$甲酸
","两个电极反应中碳原子的杂化类型均发生改变
"]$\rm H^{+}$由电极$\rm A$移向电极$\rm B$,$\rm B$电极二氧化碳发生还原反应生成甲酸,$\rm B$是阴极、$\rm A$是阳极。
$\rm A$.根据以上分析,$\rm A$是阳极,电极$\rm A$与电源正极相连 ,故$\rm A$正确;
$\rm B$.$\rm B$电极二氧化碳发生还原反应生成甲酸,电极$\rm B$的反应:$\rm C{{O}_{2}}+2{{e}^{-}}+2{{H}^{+}}=HCOOH$,故$\rm B$正确;
$\rm C$.$\rm A$电极乙二醇失电子发生氧化反应生成甲酸,电极反应式为$\rm HOC{{H}_{2}}C{{H}_{2}}OH-6{{e}^{-}}+2{{H}_{2}}O=2HCOOH+6{{H}^{+}}$ ,$\rm B$电极二氧化碳得电子发生还原反应生成甲酸,电极反应式为$\rm C{{O}_{2}}+2{{e}^{-}}+2{{H}^{+}}=HCOOH$,$\rm 1$ $\rm mol$乙二醇参加反应,阳极生成$\rm 2\ mol$甲酸,根据得失电子守恒,$\rm B$电极生成$\rm 3\ mol$甲酸,两极共生成$\rm 5$ $\rm mol$甲酸,故$\rm C$错误;
$\rm D$.乙二醇中碳原子采用$\rm sp^{3}$杂化,二氧化碳中$\rm C$原子采用$\rm sp$杂化,甲酸中两个碳原子采用$\rm sp^{2}$杂化,故$\rm D$正确;
故选:C
| 杂化轨道理论题目答案及解析(完整版)
