| 配合物理论 题目答案及解析
稿件来源:高途
| 配合物理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
配合物理论
钴及其化合物在工业与材料科学中应用广泛。回答下列问题:
关于钴原子结构的描述,下列说法正确的是 。
$\rm A$.基态$\rm Co$原子$\rm 3d$轨道上有$\rm 3$对成对电子 $\rm B$.$\rm \text{C}{{\text{o}}^{\text{3+}}}$的离子半径小于$\rm \text{F}{{\text{e}}^{\text{2+}}}$的离子半径
$\rm C$.电子排布为$\rm \left[ \text{Ar} \right]\text{3}{{\text{d}}^{\text{6}}}\text{4}{{\text{s}}^{\text{2}}}$的$\rm \text{C}{{\text{o}}^{+}}$处于基态 $\rm D$.$\rm Co$的第三电离能大于第二电离能
$\\rm BD$
"]]$\rm A$.$\rm Co$为$\rm 27$号元素,基态$\rm Co$原子价层电子排布式为$\rm 3d^{7}4s^{2}$,$\rm 3d$轨道上有$\rm 2$对成对电子,$\rm A$错误;
$\rm B$.基态$\rm Co$原子价层电子排布式为$\rm 3d^{7}4s^{2}$,基态$\rm Fe$原子价层电子排布式为$\rm 3d^{6}4s^{2}$,则$\rm \text{C}{{\text{o}}^{\text{3+}}}$和$\rm \text{F}{{\text{e}}^{\text{2+}}}$具有相同的核外电子层结构,由于核电荷数:$\rm \text{C}{{\text{o}}^{\text{3+}}}\rm \gt \text{F}{{\text{e}}^{\text{2+}}}$,则$\rm \text{C}{{\text{o}}^{\text{3+}}}$的半径小于$\rm \text{F}{{\text{e}}^{\text{2+}}}$的半径,$\rm B$正确;
$\rm C$.基态$\rm Co$原子价层电子排布式为$\rm 3d^{7}4s^{2}$,基态$\rm \text{C}{{\text{o}}^{+}}$价层电子排布式为$\rm 3d^{7}4s^{1}$,$\rm C$错误;
$\rm D$.原子的逐级电离能依次增大,则$\rm Co$的第三电离能大于第二电离能,$\rm D$正确;
某钴氧化物的晶胞结构如图所示:
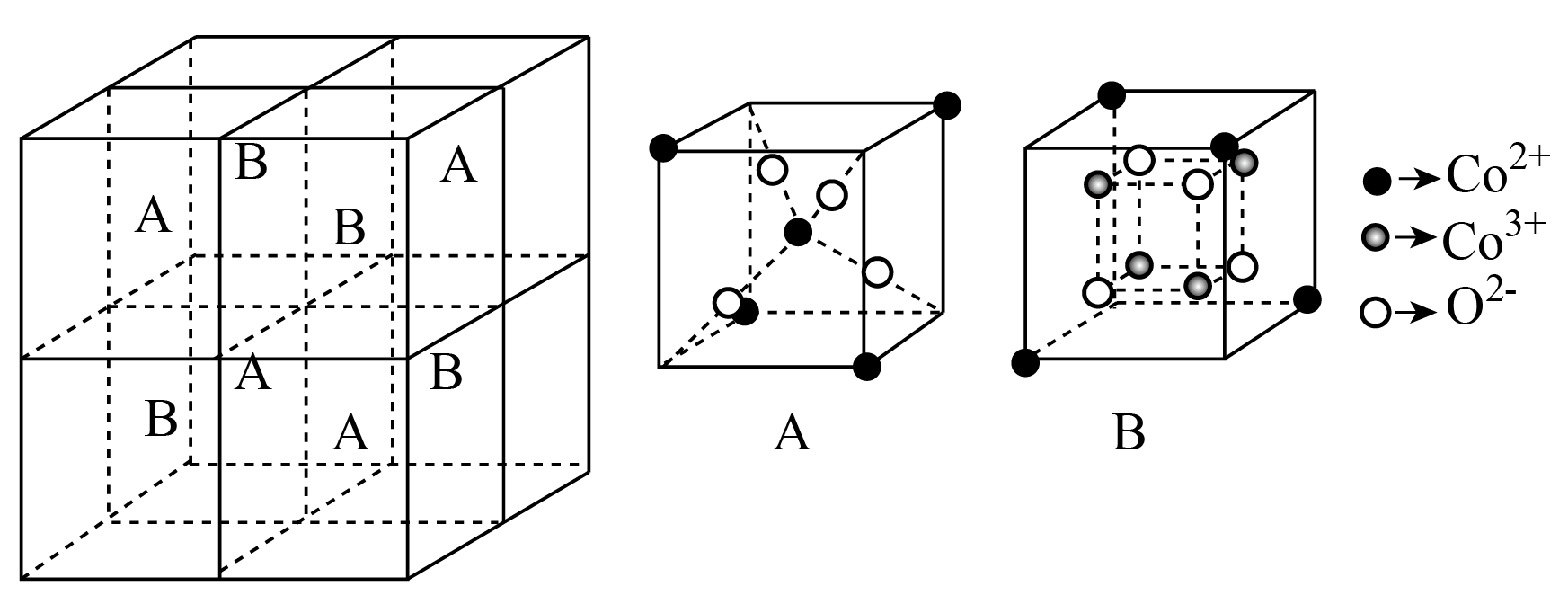
①该氧化物的化学式为 。
②已知三价钴有强氧化性,将少量该氧化物粉末加入浓盐酸中加热,生成气体的化学式为 。
$\\text{C}{{\\text{o}}_{\\text{3}}}{{\\text{O}}_{\\text{4}}}$ ; $\\text{C}{{\\text{l}}_{\\text{2}}}$
"]]①一个$\rm A$中含$\text{C}{{\text{o}}^{\text{2+}}}$:$4\times \dfrac{1}{8}+1=\dfrac{3}{2}$个,含${{\text{O}}^{2-}}\rm 4$个;一个$\rm B$中含$\text{C}{{\text{o}}^{\text{2+}}}$:$4 \times \dfrac{1}{8}=\dfrac{1}{2}$个,含${{\text{O}}^{2-}}\rm 4$个、含$\text{C}{{\text{o}}^{\text{3+}}}\rm 4$个;图中一个晶胞由$\rm 4$个$\rm A$、$\rm 4$个$\rm B$构成,则一个晶胞可视为含$\rm 2$个$\text{C}{{\text{o}}^{\text{2+}}}$、$\rm 4$个$\text{C}{{\text{o}}^{\text{3+}}}$、$\rm 8$个${{\text{O}}^{2-}}$,该氧化物的化学式为$\text{C}{{\text{o}}_{\text{3}}}{{\text{O}}_{\text{4}}}$。
②三价钴有强氧化性,则$\text{C}{{\text{o}}_{\text{3}}}{{\text{O}}_{\text{4}}}$能与浓盐酸在加热条件下发生氧化还原反应,浓盐酸被氧化为氯气,化学方程式为$\text{C}{{\text{o}}_{\text{3}}}{{\text{O}}_{\text{4}}}+8\text{HCl}(浓)\begin{matrix} \underline{\underline{{\triangle }}} \\ {} \\ \end{matrix}\text{3CoC}{{\text{l}}_{\text{2}}}\text{+C}{{\text{l}}_{\text{2}}}\uparrow \text{+4}{{\text{H}}_{\text{2}}}\text{O}$,所以生成气体的化学式为$\rm Cl_{2}$。
$\text{C}{{\text{o}}^{\text{2+}}}$与$\text{N}{{\text{H}}_{\text{3}}}$形成的配合物${{\left[ \text{Co}{{\left( \text{N}{{\text{H}}_{\text{3}}} \right)}_{6}} \right]}^{2+}}$的稳定性高于${{\left[ \text{Co}{{\left( {{\text{H}}_{\text{2}}}\text{O} \right)}_{\text{6}}} \right]}^{\text{2+}}}$,从配位键强度分析原因 。
电负性:$\\rm N\\lt O$,$\\text{N}{{\\text{H}}_{\\text{3}}}$更容易给出孤电子对,配位能力强于${{\\text{H}}_{\\text{2}}}\\text{O}$
"]]一个$\text{N}{{\text{H}}_{\text{3}}}$中$\rm N$的孤电子对数为$\dfrac{5-3\times 1}{2}=1$,一个${{\text{H}}_{\text{2}}}\text{O}$中$\rm O$的孤电子对数为$\dfrac{6-2\times 1}{2}=2$,$\rm N$、$\rm O$均能提供孤电子对与$\text{C}{{\text{o}}^{\text{2+}}}$形成配位键,由于电负性:$\rm N\lt O$,$\text{N}{{\text{H}}_{\text{3}}}$更容易给出孤电子对,配位能力强于${{\text{H}}_{\text{2}}}\text{O}$,所以${{\left[ \text{Co}{{\left( \text{N}{{\text{H}}_{\text{3}}} \right)}_{6}} \right]}^{2+}}$的稳定性高于$\left[\mathrm{Co}\left(\mathrm{H}_{2} \mathrm{O}\right)_{6}\right]^{2+}$。
工业上以钴硫精矿$\rm ($主要成分为$\rm CoS$,含$\text{Fe}{{\text{S}}_{2}}、\text{Si}{{\text{O}}_{\text{2}}}、\text{Mn}{{\text{O}}_{\text{2}}}$等杂质$\rm )$为原料制备金属钴的流程如下图:
![]()
已知:
| 沉淀 | $\text{Fe}{{\left( \text{OH} \right)}_{\text{3}}}$ | $\text{Co}{{\left( \text{OH} \right)}_{\text{2}}}$ | $\text{Fe}{{\left( \text{OH} \right)}_{\text{2}}}$ | $\text{Mn}{{\left( \text{OH} \right)}_{\text{2}}}$ |
恰好完全沉淀时$\text{pH}$ | $\rm 2.8$ | $\rm 9.4$ | $\rm 9.6$ | $\rm 10.1$ |
①为提高“酸浸”效率,可采取的措施有 。$\rm ($写出两种$\rm )$
②“氧化”过程是向溶液中加入足量$\text{NaCl}{{\text{O}}_{\text{3}}}$,发生的离子方程式为 。
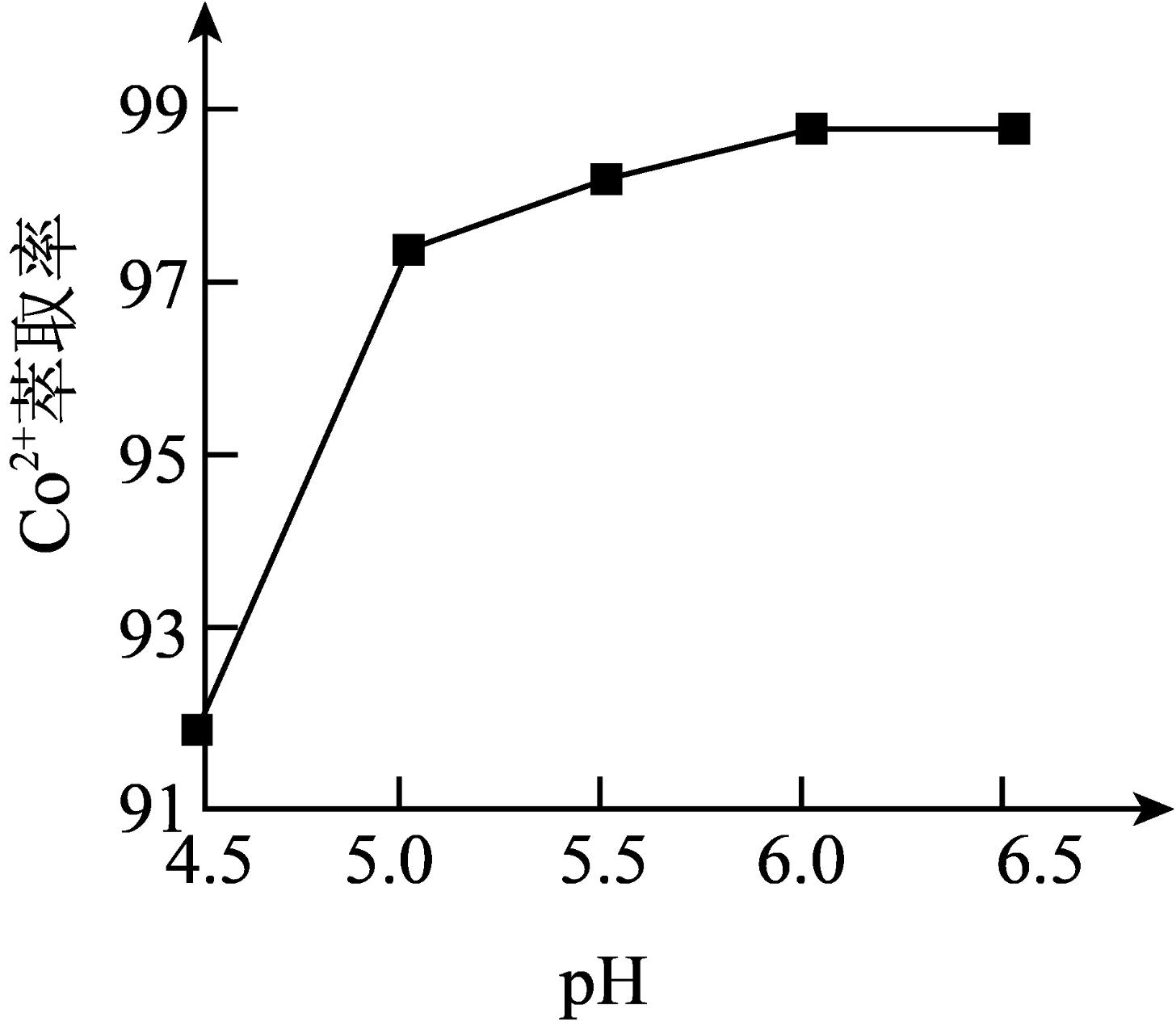
③“萃取、反萃取”过程是向“沉铁”后的溶液中,加入某有机酸萃取剂${{\left( \text{HA} \right)}_{\text{2}}}$,发生反应:$\text{C}{{\text{o}}^{\text{2}+}}+n{{\left( \text{HA} \right)}_{2}}\rightleftharpoons \text{Co}{{\text{A}}_{2}}\cdot \left( n-1 \right){{\left( \text{HA} \right)}_{2}}+2{{\text{H}}^{+}}$,实验测得:当溶液$\text{pH}$处于$\rm 4.5$~$\rm 6.5$范围内,$\text{C}{{\text{o}}^{\text{2}+}}$萃取率随溶液$\text{pH}$的增大而增大$\rm ($如图所示$\rm )$,其原因是 。
④向萃取所得有机相中加入${{\text{H}}_{\text{2}}}\text{S}{{\text{O}}_{\text{4}}}$,反萃取得到水相。该工艺中设计萃取、反萃取的目的是 。
适当提高酸的浓度,适当提高反应体系的温度,将焙烧后矿物粉碎等 ; $\\text{6F}{{\\text{e}}^{2+}}+\\text{ClO}_{\\text{3}}^{-}+6{{\\text{H}}^{+}}=6\\text{F}{{\\text{e}}^{\\text{3}+}}+\\text{C}{{\\text{l}}^{-}}+3{{\\text{H}}_{\\text{2}}}\\text{O}$;$\\text{pH}$增大,$c\\left( {{\\text{H}}^{+}} \\right)$减小,使$\\text{C}{{\\text{o}}^{\\text{2+}}}+n{{\\left( \\text{HA} \\right)}_{2}}\\rightleftharpoons \\text{Co}{{\\text{A}}_{2}}\\cdot \\left( n-1 \\right){{\\left( \\text{HA} \\right)}_{2}}+2{{\\text{H}}^{+}}$平衡正向进行,所以$\\text{C}{{\\text{o}}^{\\text{2+}}}$萃取率增大 ; 富集、提纯$\\text{C}{{\\text{o}}^{\\text{2+}}}$ $\\rm ($或分离$\\text{C}{{\\text{o}}^{\\text{2+}}}$和$\\text{M}{{\\text{n}}^{\\text{2+}}}\\rm )$
"]]以钴硫精矿$\rm ($主要成分为$\rm CoS$,含$\text{Fe}{{\text{S}}_{2}}、\text{Si}{{\text{O}}_{\text{2}}}、\text{Mn}{{\text{O}}_{\text{2}}}$等杂质$\rm )$为原料制备金属钴,矿石经焙烧酸浸,所得酸浸液中的主要阳离子为$\text{C}{{\text{o}}^{\text{2+}}}$、$\text{F}{{\text{e}}^{\text{2+}}}$、$\text{M}{{\text{n}}^{2+}}$,加入足量$\text{NaCl}{{\text{O}}_{\text{3}}}$可将$\text{F}{{\text{e}}^{\text{2+}}}$氧化为$\text{F}{{\text{e}}^{\text{3+}}}$,之后沉铁将铁元素以$\text{Fe(OH}{{\text{)}}_{\text{3}}}$形式除去,再加入某有机酸萃取剂${{\left( \text{HA} \right)}_{\text{2}}}$萃取$\text{C}{{\text{o}}^{\text{2+}}}$,从而将$\text{C}{{\text{o}}^{\text{2+}}}$和$\text{M}{{\text{n}}^{\text{2+}}}$分离,经反萃取后得到含$\text{C}{{\text{o}}^{\text{2+}}}$溶液,经电解精炼可制备金属钴。
①为提高“酸浸”效率,可采取的措施:适当提高酸的浓度,适当提高反应体系的温度,将焙烧后矿物粉碎等。
②“氧化”过程是向溶液中加入足量$\text{NaCl}{{\text{O}}_{\text{3}}}$,$\text{NaCl}{{\text{O}}_{\text{3}}}$可将$\text{F}{{\text{e}}^{\text{2+}}}$氧化为$\text{F}{{\text{e}}^{\text{3+}}}$而自身被还原为$\text{C}{{\text{l}}^{-}}$,根据化合价升降守恒、电荷守恒、原子守恒可得到反应的离子方程式:$\text{6F}{{\text{e}}^{2+}}+\text{ClO}_{\text{3}}^{-}+6{{\text{H}}^{+}}=6\text{F}{{\text{e}}^{\text{3}+}}+\text{C}{{\text{l}}^{-}}+3{{\text{H}}_{\text{2}}}\text{O}$。
③图中当溶液$\text{pH}$处于$\rm 4.5$~$\rm 6.5$范围内,$\text{C}{{\text{o}}^{\text{2}+}}$萃取率随溶液$\text{pH}$的增大而增大的原因是$\text{pH}$增大导致溶液中$c\left( {{\text{H}}^{+}} \right)$减小,使$\text{C}{{\text{o}}^{\text{2}+}}+n{{\left( \text{HA} \right)}_{2}}\rightleftharpoons \text{Co}{{\text{A}}_{2}}\cdot \left( n-1 \right){{\left( \text{HA} \right)}_{2}}+2{{\text{H}}^{+}}$平衡正向进行,所以$\text{C}{{\text{o}}^{\text{2+}}}$萃取率增大。
④结合分析知,该工艺中设计萃取、反萃取的目的是富集、提纯$\text{C}{{\text{o}}^{\text{2+}}}$ $\rm ($或分离$\text{C}{{\text{o}}^{\text{2+}}}$和$\text{M}{{\text{n}}^{\text{2+}}}\rm )$。
| 配合物理论题目答案及解析(完整版)
