高中 | 氯气 题目答案及解析
稿件来源:高途
高中 | 氯气题目答案及解析如下,仅供参考!
必修一
第四章 非金属及其化合物
第二节 富集在海水中的元素——氯
氯气
两种制备$\rm NaCl{{O}_{2}}$的方案如下:
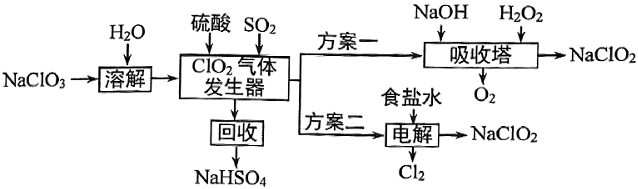
下列离子方程式书写错误的是$\rm (\qquad)$
$\\rm NaCl{{O}_{2}}$的水溶液呈碱性:$\\rm ClO_{2}^{-}+{{H}_{2}}O\\rightleftharpoons HCl{{O}_{2}}+O{{H}^{-}}$
","“$\\rm Cl{{O}_{2}}$发生器”:$\\rm S{{O}_{2}}+2ClO_{3}^{-}=SO_{4}^{2-}+2Cl{{O}_{2}}$
","“吸收塔”:$\\rm 6O{{H}^{-}}+6Cl{{O}_{2}}+{{H}_{2}}{{O}_{2}}=6ClO_{2}^{-}+2{{O}_{2}}+4{{H}_{2}}O$
","“电解”:$\\rm 2C{{l}^{-}}+2Cl{{O}_{2}}\\begin{matrix} \\underline{\\underline{电解}} \\\\ {} \\\\ \\end{matrix}C{{l}_{2}}+2ClO_{2}^{-}$
"]$\rm NaClO_{3}$在“$\rm Cl{{O}_{2}}$发生器”中被$\rm SO2$还原为$\rm Cl{{O}_{2}}$,$\rm Cl{{O}_{2}}$在“吸收塔”中被双氧水还原为$\rm NaCl{{O}_{2}}$;$\rm Cl{{O}_{2}}$、氯化钠溶液电解生成$\rm NaCl{{O}_{2}}$、氯气。
$\rm A$.$\rm NaCl{{O}_{2}}$是强碱弱酸盐,$\rm ClO_{2}^{-}$水解使溶液呈碱性,$\rm ClO_{2}^{-}$水解的离子方程式为$\rm ClO_{2}^{-}+{{H}_{2}}O\rightleftharpoons HCl{{O}_{2}}+O{{H}^{-}}$,故$\rm A$正确。
$\rm B$.“$\rm Cl{{O}_{2}}$发生器”中$\rm ClO_{3}^{-}$被$\rm SO_{2}$还原为$\rm Cl{{O}_{2}}$,$\rm SO_{2}$氧化为$\rm SO_{4}^{2-}$,根据得失电子守恒配平反应的离子方程式为$\rm S{{O}_{2}}+2ClO_{3}^{-}=SO_{4}^{2-}+2Cl{{O}_{2}}$,故$\rm B$正确。
$\rm C$.“吸收塔”中$\rm Cl{{O}_{2}}$被双氧水还原为$\rm ClO_{2}^{-}$,双氧水被氧化为氧气,反应的离子方程式为$\rm 2O{{H}^{-}}+2Cl{{O}_{2}}+{{H}_{2}}{{O}_{2}}=2ClO_{2}^{-}+{{O}_{2}}+2{{H}_{2}}O$,故$\rm C$错误。
$\rm D$.“电解”时,$\rm Cl{{O}_{2}}$在阴极发生还原反应生成$\rm ClO_{2}^{-}$,$\rm Cl^{-}$在阳极发生氧化反应生成氯气,反应的离子方程式为$\rm 2C{{l}^{-}}+2Cl{{O}_{2}}\begin{matrix} \underline{\underline{电解}} \\ {} \\ \end{matrix}C{{l}_{2}}+2ClO_{2}^{-}$,故$\rm D$正确。
故选:$\rm C$
高中 | 氯气题目答案及解析(完整版)
