高中 | 氯气 题目答案及解析
稿件来源:高途
高中 | 氯气题目答案及解析如下,仅供参考!
必修一
第四章 非金属及其化合物
第二节 富集在海水中的元素——氯
氯气
$\rm CuCl$用途广泛,某研究性小组拟热分解$\rm CuCl_{2}\cdot 2H_{2}O$制备$\rm CuCl$。
$\rm [$资料查阅$\rm ]$
ⅰ$\rm .$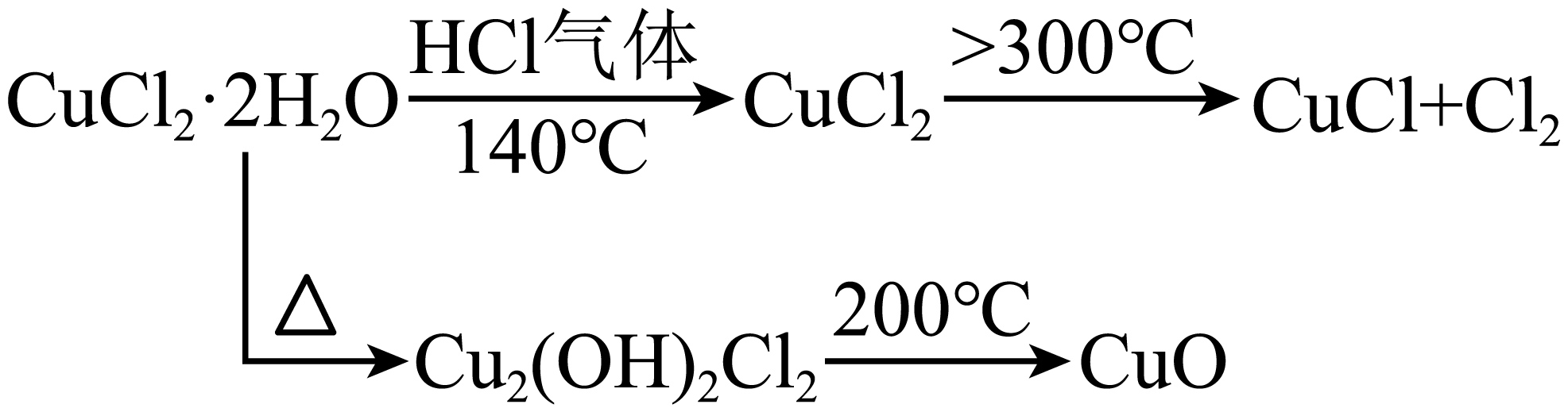
ⅱ$\rm .$实验室使用浓硫酸制备$\rm HCl$气体的原理如下:$\rm NaCl(s)+{{H}_{2}}S{{O}_{4}}(浓)\begin{matrix} \underline{\underline{微热}} \\ {} \\ \end{matrix}NaHS{{O}_{4}}+HCl\uparrow $
$\rm [$实验探究$\rm ]$该小组用下图所示装置进行实验$\rm ($央持仪器略$\rm )$,
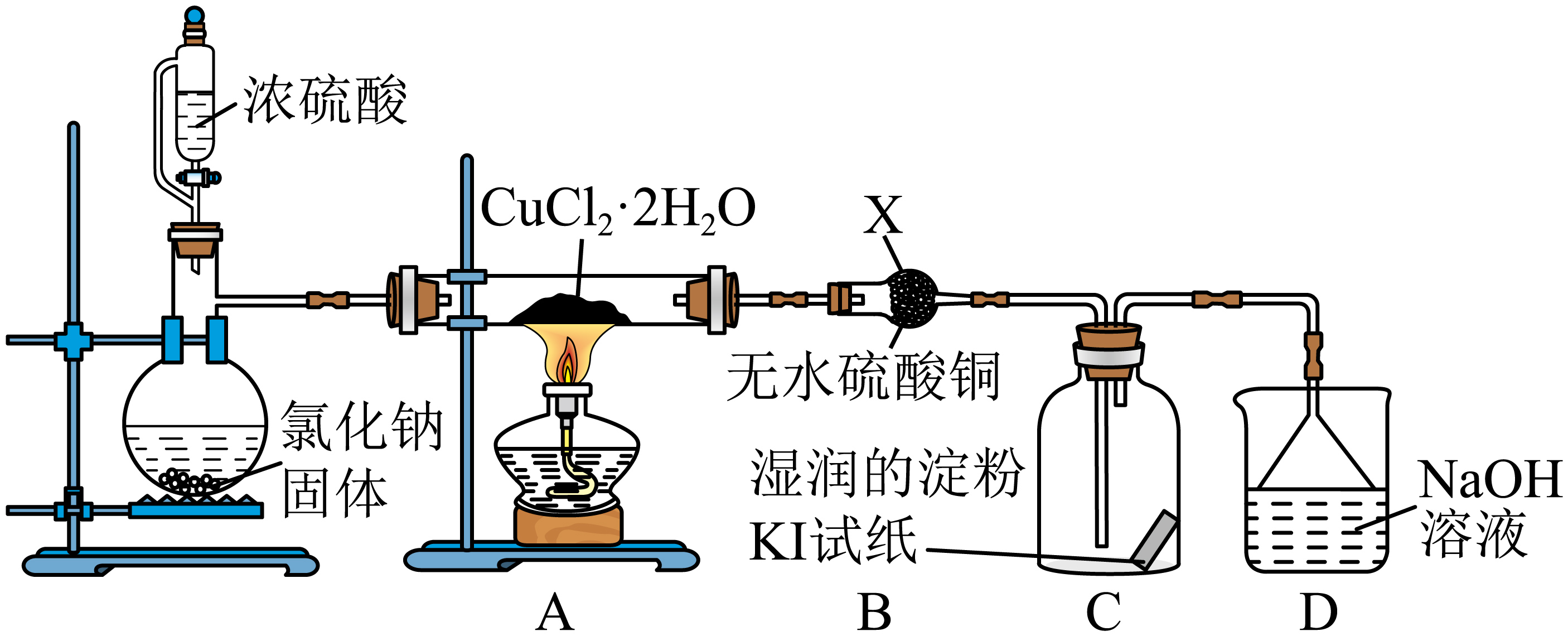
请回答下列问题:
制备氯化氢的过程体现了浓硫酸具有________。
$\rm A$.酸性 $\rm B$.强氧化性 $\rm C$.难挥发性 $\rm D$.吸水性
$\\rm C$
"]]制备氯化氢的过程反应原理为:$\rm NaCl+H_{2}SO_{4}(浓)\begin{matrix} \underline{\underline{\triangle}} \\ {} \\ \end{matrix}NaHSO_{4}+HCl↑$,则体现了浓硫酸具有难挥发性,即难挥发性酸制备挥发性酸。
使用恒压分液漏斗制备$\rm HCl$气体的优点是 ;$\rm X$装置的名称为 。
保持内外压强一致使得液体顺利流下;干燥管
"]]使用恒压分液漏斗制备$\rm HCl$气体的优点是保持内外压强一致使得液体顺利流下,由题干实验装置图可知,$\rm X$装置的名称为干燥管。
$\rm C$中试纸变蓝后会逐渐褪色,写出褪色过程中发生的化学反应方程式 。
$\\rm {{I}_{2}}+5C{{l}_{2}}+6{{H}_{2}}O=2HI{{O}_{3}}+10HCl$
"]]由分析可知,制备$\rm CuCl$过程中产生$\rm Cl_{2}$,$\rm Cl_{2}$能氧化$\rm KI$为$\rm I_{2}$,从而使湿润的$\rm KI$淀粉试纸变蓝,但由于$\rm Cl_{2}$具有强氧化性,能够将$\rm I_{2}$氧化为更高价态的含碘化合物,故$\rm C$中试纸变蓝后会逐渐褪色,褪色过程中发生的化学反应方程式为:$\rm {{I}_{2}}+5C{{l}_{2}}+6{{H}_{2}}O=2HI{{O}_{3}}+10HCl$。
装置$\rm D$中发生的离子方程式为 。
$\\rm C{{l}_{2}}+2O{{H}^{-}}=C{{l}^{-}}+Cl{{O}^{-}}+{{H}_{2}}O$、$\\rm {{H}^{+}}+O{{H}^{-}}={{H}_{2}}O$
"]]由分析可知,装置$\rm D$的作用为吸收尾气中的$\rm Cl_{2}$和$\rm HCl$,防止污染环境,则其中发生的离子方程式为:$\rm C{{l}_{2}}+2O{{H}^{-}}=C{{l}^{-}}+Cl{{O}^{-}}+{{H}_{2}}O$、$\rm {{H}^{+}}+O{{H}^{-}}={{H}_{2}}O$。
反应结束后,取出$\rm CuCl$产品进行实验,发现其中含有少量的$\rm CuCl_{2}$或$\rm CuO$杂质,根据资料信息分析:
①若杂质是$\rm CuCl_{2}$,则产生的原因是 。
②若杂质是$\rm CuO$,则产生的原因是 。
加热温度不够高,不到$\\rm 300\\ ^\\circ \\text{C}$,$\\rm CuCl_{2}$未完全分解;通入$\\rm HCl$的量太少$\\rm ($氯化氢中含有一定水分$\\rm )$,产生$\\rm Cu_{2}(OH)_{2}Cl_{2}$后分解产生$\\rm CuO$
"]]①若杂质是$\rm CuCl_{2}$,则产生的原因是加热温度不够高,不到$\rm 300\ ^\circ \text{C}$,$\rm CuCl_{2}$未完全分解。
②若杂质是$\rm CuO$,则产生的原因是通入$\rm HCl$的量太少$\rm ($氯化氢中含有一定水分$\rm )$,$\rm Cu^{2+}$水解产生$\rm Cu_{2}(OH)_{2}Cl_{2}$后分解产生$\rm CuO$。
准确称取所制备的氯化亚铜样品$m\ \rm g$,将其置于过量的$\rm FeCl_{3}$溶液中,待样品完全溶解后,加入适量稀硫酸,配成$\rm 100\ mL$溶液,取出$\rm 10.00\ mL$,用$a\ \rm mol/L$的$\rm K_{2}Cr_{2}O_{7}$标准溶液滴定到终点,消耗$\rm K_{2}Cr_{2}O_{7}$溶液$b\ \rm mL$,反应中$\rm C{{r}_{2}}O_{7}^{2-}$被还原为$\rm Cr^{3+}$。$\rm CuCl+FeCl_{3}=FeCl_{2}+CuCl_{2}$
配制$\rm 100\ mL$待测液用不到的仪器有________。
$\rm A$.容量瓶 $\rm B$.烧杯 $\rm C$.分液漏斗 $\rm D$.胶头滴管
$\\rm C$
"]]用固体配制$\rm 100\ mL$一定物质的量浓度的待测液需要使用的仪器有:天平、烧杯、玻璃棒、$\rm 100\ mL$容量瓶、胶头滴管,则配制用不到的仪器有分液漏斗。
样品中$\rm CuCl$的质量分数为 $\rm ($结果化简,$M\rm (Cu)=64$,$M\rm (Cl)=35.5)$。
$\\dfrac{597ab}{m}\\%$
"]]根据反应方程式:$\rm CuCl+FeCl_{3}=FeCl_{2}+CuCl_{2}$,$\rm Fe^{2+}$的还原性强于$\rm Cl^{-}$,故可用$a\ \rm mol/L$的$\rm K_{2}Cr_{2}O_{7}$标准溶液滴定到终点,消耗$\rm K_{2}Cr_{2}O_{7}$溶液$b\ \rm mL$,反应中$\rm C{{r}_{2}}O_{7}^{2-}$被还原为$\rm Cr^{3+}$,反应原理为:$\rm 6Fe^{2+}+C{{r}_{2}}O_{7}^{2-}+14H^{+}=6Fe^{3+}+2Cr^{3+}+7H_{2}O$,则有$\rm 6CuCl\sim 6Fe^{2+}\sim C{{r}_{2}}O_{7}^{2-}$,则有:$n{\rm (CuCl)}=n{\rm (Fe^{2+})}=6n{\rm (C{{r}_{2}}O_{7}^{2-})}=6ab\times 10^{-3}\rm \ mol$,故样品中$\rm CuCl$的质量分数为$\dfrac{6ab\times 1{{0}^{-3}}\ {\rm mol}\times 99.5\rm \ g/mol\times \dfrac{100\ mL}{10\ mL}}{m\ \rm g}\times 100 \%=\dfrac{597ab}{m}\%$。
若测定结果偏大可能的原因是________。
$\rm A$.样品中混有$\rm CuO$
$\rm B$.滴定前滴定管尖嘴处有小液滴,滴定后消失
$\rm C$.滴定管未用$\rm K_{2}Cr_{2}O_{7}$标准溶液润洗
$\rm D$.装待测液前锥形瓶内残留少量水
$\\rm C$
"]]$\rm A$.样品中混有$\rm CuO$,导致生成的$\rm Fe^{2+}$偏小,消耗标准液的体积偏小,则所测量结果偏小,$\rm A$不合题意。
$\rm B$.滴定前滴定管尖嘴处有小液滴,滴定后消失,导致消耗的标准液的体积偏小,所测量结果偏小,$\rm B$不合题意。
$\rm C$.滴定管未用$\rm K_{2}Cr_{2}O_{7}$标准溶液润洗,导致标准液浓度偏小,消耗标准液的体积偏大,所测量结果偏大,$\rm C$符合题意。
$\rm D$.装待测液前锥形瓶内残留少量水对实验结果无影响,$\rm D$不合题意。
高中 | 氯气题目答案及解析(完整版)
