高中 | 金属铝 题目答案及解析
稿件来源:高途
高中 | 金属铝题目答案及解析如下,仅供参考!
必修一
第三章 金属及其化合物
第一节 金属的化学性质
金属铝
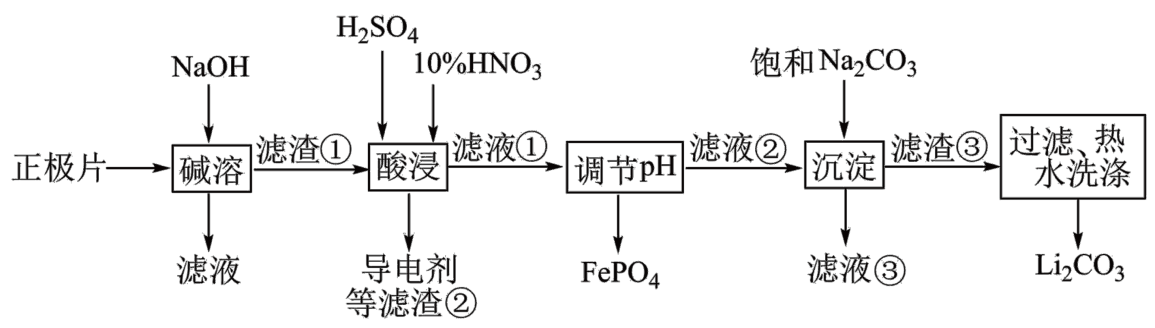
回收废旧磷酸亚铁锂电池正极片$\rm ($除$\rm LiFePO_{4}$外,还含有$\rm Al$箔、少量不溶于酸碱的导电剂$\rm )$中的资源,部分流程如图:
资料:碳酸锂在水中溶解度:
| 温度$\rm /^\circ\rm C$ | $\rm 0$ | $\rm 20$ | $\rm 40$ | $\rm 60$ | $\rm 80$ | $\rm 100$ |
| 溶解度$/\text{g}$ | $\rm 1.54$ | $\rm 1.33$ | $\rm 1.17$ | $\rm 1.01$ | $\rm 0.85$ | $\rm 0.72$ |
“碱溶”时$\text{Al}$箔溶解的离子方程式为 ,为提高“碱溶”速率,可采用的措施有 $\rm ($答一个$\rm )$。
$\\text{2Al}+\\text{2O}{{\\text{H}}^{-}}+\\text{6}{{\\text{H}}_{\\text{2}}}\\text{O}=\\text{2Al(OH)}_{\\text{4}}^{-}+\\text{3}{{\\text{H}}_{\\text{2}}}\\uparrow $ ; 对正极片进行粉碎处理或适当升温,或适当增大碱的浓度
"]]碱溶时$\text{Al}$箔与氢氧化钠反应,溶解的离子方程式$\text{2Al}+\text{2O}{{\text{H}}^{-}}+\text{6}{{\text{H}}_{\text{2}}}\text{O}=\text{2Al(OH)}_{\text{4}}^{-}+\text{3}{{\text{H}}_{\text{2}}}\uparrow $,对进行正极片粉碎处理或适当升温,或适当增大酸的浓度,均可增大碱溶速率;
最后一个步骤中,用“热水洗涤”的目的是 。
洗去表面吸附的杂质离子,减少$\\text{L}{{\\text{i}}_{2}}\\text{C}{{\\text{O}}_{3}}$的溶解损失
"]]据表格数据可知,$\rm Li_{2}CO_{3}$的溶解度随温度的升高而减小,热水洗涤可减少$\rm Li_{2}CO_{3}$的溶解,同时能够洗去$\rm Li_{2}CO_{3}$表面附着的杂质离子;
工业上,将$\text{L}{{\text{i}}_{2}}\text{C}{{\text{O}}_{3}}$粗品制备成高纯$\text{L}{{\text{i}}_{2}}\text{C}{{\text{O}}_{3}}$的部分工艺如下:
$\rm a$.将$\rm \text{L}{{\text{i}}_{2}}\text{C}{{\text{O}}_{3}}$溶于盐酸作电解槽的阳极液,$\rm \text{LiOH}$溶液作阴极液,两者用离子选择性透过膜隔开,用惰性电极电解。
$\rm b$.电解后向$\rm \text{LiOH}$溶液中加入少量$\rm \text{N}{{\text{H}}_{4}}\text{HC}{{\text{O}}_{3}}$溶液并共热,过滤、烘干得高纯$\rm \text{L}{{\text{i}}_{2}}\text{C}{{\text{O}}_{3}}$。
①$\rm a$中电解时所用的是 $\rm ($填“阳离子交换膜”或“阴离子交换膜”$\rm )$。
②电解后,$\text{LiOH}$溶液浓度增大的原因是 。
阳离子交换膜 ; 阴极反应式为$2{{\\text{H}}_{2}}\\text{O}+2{{\\text{e}}^{-}}={{\\text{H}}_{2}}\\uparrow +2\\text{O}{{\\text{H}}^{-}}$,电解过程中$\\text{L}{{\\text{i}}^{+}}$从阳极通过阳离子交换膜进入阴极溶液,因此$\\text{LiOH}$浓度增大
"]]①$\rm Li_{2}CO_{3}$溶于盐酸生成$\rm LiCl$,电解$\rm LiCl$溶液,溶液中$\rm Cl^{-}$失去电子在阳极生成$\rm Cl_{2}$,阴极反应式为$2{{\text{H}}_{2}}\text{O}+2{{\text{e}}^{-}}={{\text{H}}_{2}}\uparrow +2\text{O}{{\text{H}}^{-}}$,电解过程中$\rm Li^{+}$从阳极通过阳离子交换膜进入阴极溶液,因此$\rm LiOH$浓度增大,则$\text{a}$中电解时所用的是阳离子交换膜;
②由①电解后,阴极反应式为$2{{\text{H}}_{2}}\text{O}+2{{\text{e}}^{-}}={{\text{H}}_{2}}\uparrow +2\text{O}{{\text{H}}^{-}}$,电解过程中$\rm Li^{+}$从阳极通过阳离子交换膜进入阴极溶液,因此$\rm LiOH$浓度增大;
磷酸亚铁锂电池总反应为:$\text{LiFeP}{{\text{O}}_{4}}+6\text{C}\rightleftharpoons \text{L}{{\text{i}}_{1-x}}\text{FeP}{{\text{O}}_{4}}+\text{L}{{\text{i}}_{x}}{{\text{C}}_{6}}$电池中的固体电解质可传导$\text{Li}{{}^{+}}$。放电时,正极反应式为 。
$\\text{L}{{\\text{i}}_{1-x}}\\text{FeP}{{\\text{O}}_{4}}+x\\text{L}{{\\text{i}}^{+}}+x{{\\text{e}}^{-}}=\\text{LiFeP}{{\\text{O}}_{4}}$
"]]放电时,正极发生还原反应,$\text{L}{{\text{i}}_{1-x}}\text{FeP}{{\text{O}}_{4}}$转化为$\text{LiFeP}{{\text{O}}_{4}}$,根据得失电子守恒和电荷守恒配平正极反应式为$\text{L}{{\text{i}}_{1-x}}\text{FeP}{{\text{O}}_{4}}+x\text{L}{{\text{i}}^{+}}+x{{\text{e}}^{-}}=\text{LiFeP}{{\text{O}}_{4}}$;
工业上将回收的$\text{L}{{\text{i}}_{2}}\text{C}{{\text{O}}_{3}}$、$\text{FeP}{{\text{O}}_{4}}$粉碎与足量的炭黑混合高温灼烧再生制备$\text{LiFeP}{{\text{O}}_{4}}$,反应的化学方程式为: 。
$\\text{L}{{\\text{i}}_{2}}\\text{C}{{\\text{O}}_{3}}+2\\text{FeP}{{\\text{O}}_{4}}+2\\text{C}\\begin{matrix} \\underline{\\underline{高温}} \\\\ {} \\\\\\end{matrix}2\\text{LiFeP}{{\\text{O}}_{4}}+3\\text{CO}\\uparrow $
"]]根据题意可知,反应物为$\text{L}{{\text{i}}_{2}}\text{C}{{\text{O}}_{3}}$、$\text{FeP}{{\text{O}}_{4}}$、炭黑,生成物为$\text{LiFeP}{{\text{O}}_{4}}$,根据元素守恒分析另一种产物为碳的氧化物,因炭黑足量,故为$\text{CO}$,其反应的化学方程式为:$\text{L}{{\text{i}}_{2}}\text{C}{{\text{O}}_{3}}+2\text{FeP}{{\text{O}}_{4}}+2\text{C}\begin{matrix} \underline{\underline{高温}} \\ {} \\\end{matrix}2\text{LiFeP}{{\text{O}}_{4}}+3\text{CO}\uparrow $;
$\text{LiP}{{\text{F}}_{6}}$、$\text{LiAs}{{\text{F}}_{6}}$和$\text{LiCl}$等可作为聚乙二醇锂离子电池的电极材料。电池放电时,$\text{Li}{{}^{+}}$沿聚乙二醇分子中的碳氧链向正极迁移的过程如图所示$\rm ($图中阴离子未画出$\rm )$。
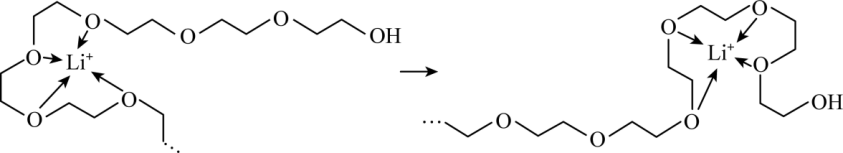
相同条件下,电极材料 $\rm ($填“$\text{LiP}{{\text{F}}_{6}}$”或“$\text{LiAs}{{\text{F}}_{6}}$”$\rm )$中的$\text{L}{{\text{i}}^{+}}$迁移较快,原因是: 。$\rm ($从晶体性质角度解释$\rm )$
$\\text{LiAs}{{\\text{F}}_{6}}$ ; $\\text{LiAs}{{\\text{F}}_{6}}$中阴离子半径大于$\\text{LiP}{{\\text{F}}_{6}}$,故晶格能更小,阴阳离子间吸引力更弱,$\\text{L}{{\\text{i}}^{+}}$更易迁移
"]]$\rm Li^{+}$会受到阴离子的吸引而影响迁移速度,$\text{LiAsF}{{}_{6}}$中阴离子半径大于$\text{LiP}{{\text{F}}_{6}}$,故晶格能更小,阴阳离子间吸引力更弱,$\rm Li^{+}$更易迁移,所以电极材料$\text{LiAs}{{\text{F}}_{6}}$中的$\rm Li^{+}$迁移较快。
高中 | 金属铝题目答案及解析(完整版)
