高中 | 铁盐 亚铁盐 题目答案及解析
稿件来源:高途
高中 | 铁盐 亚铁盐题目答案及解析如下,仅供参考!
必修一
第三章 金属及其化合物
第二节 几种重要的金属化合物
铁盐 亚铁盐
硫化锌$\rm (ZnS)$是一种重要的化工原料,难溶于水,可由炼锌的废渣锌灰$\rm ($含$\rm ZnO$及少量$\rm Fe$、$\rm Cu$、$\rm Pb$等金属的氧化物$\rm )$制取,某学习小组在实验室模拟制备$\rm ZnS$的流程如下:
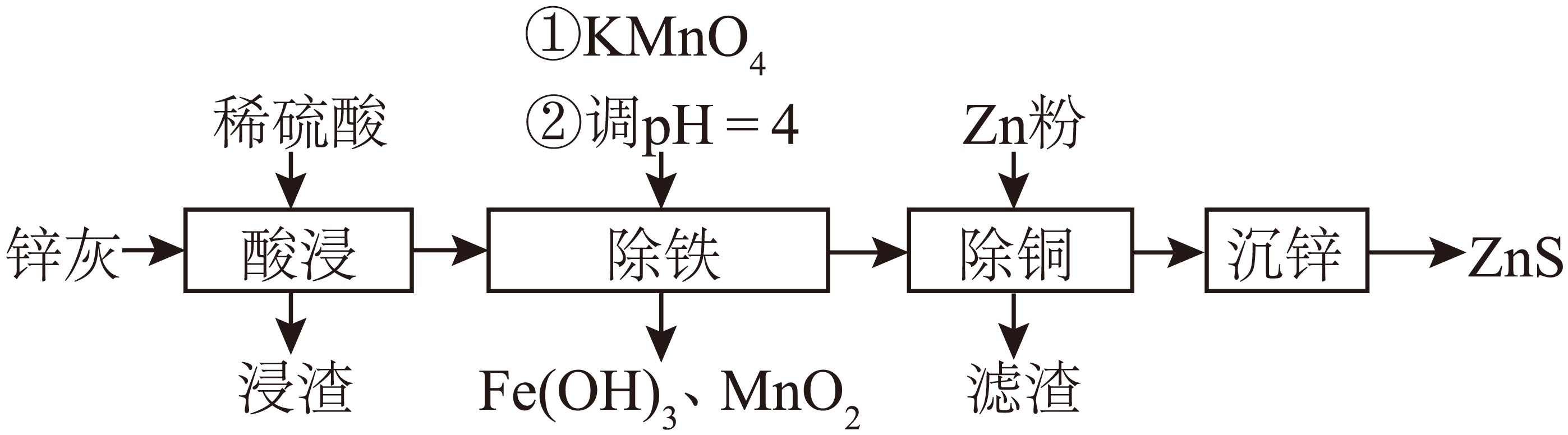
回答下列问题:
为提高锌灰的浸取效率,不宜采用的方法是 $\rm ($填字母$\rm )$。
$\rm A$.搅拌 $\rm B$.加压 $\rm C$.升高温度 $\rm D$.多次浸取
$\\rm B$
"]]搅拌、升高温度都可以加快浸取速率,从而提高浸取效率,多次浸取也可以使浸取更彻底,提高浸取效率,浸取是溶液中的反应,加压无影响,无法提高浸取效率,故不宜采用的方法是加压;
“浸渣”的主要成分为 $\rm ($填化学式$\rm )$。
$\\text{PbS}{{\\text{O}}_{4}}$
"]]由分析可知,“浸渣”的主要成分为难溶的硫酸盐$\rm PbSO_{4}$;
写出“除铁”时步骤①中发生反应的离子方程式: 。
$3\\text{F}{{\\text{e}}^{2+}}+\\text{MnO}_{4}^{-}+4{{\\text{H}}^{+}}=3\\text{F}{{\\text{e}}^{3+}}+\\text{Mn}{{\\text{O}}_{2}}\\downarrow +2{{\\text{H}}_{2}}\\text{O}$
"]]“除铁”时高锰酸钾将$\rm Fe^{2+}$氧化为$\rm Fe^{3+}$,还原产物为$\rm MnO_{2}$,离子方程式为$\rm 3Fe^{2+}+\text{MnO}_{4}^{-}\rm +4H^{+}=3Fe^{3+}+MnO_{2}↓+2H_{2}O$;
“除铁”时若加入的$\text{KMn}{{\text{O}}_{4}}$不足,则除铁后的溶液中会含有$\rm Fe$元素。请设计实验方案加以证明: 。
取样,向其中滴入$\\rm KSCN$溶液无现象,再滴加${{\\text{H}}_{2}}{{\\text{O}}_{2}}$溶液,若溶液变红或向其中滴加${{\\text{K}}_{3}}\\left[ \\text{Fe}{{\\left( \\text{CN} \\right)}_{6}} \\right]$溶液,若产生蓝色沉淀,则溶液中含有$\\rm Fe$元素
"]]“除铁”时若加入的$\rm KMnO_{4}$不足,由于$\rm Fe^{2+}$以氢氧化物沉淀需要更大的$\rm pH$,故除铁后的溶液中会含有$\rm Fe^{2+}$,故只需检验$\rm Fe^{2+}$的存在,方案为:取样,向其中滴入$\rm KSCN$溶液无现象,再滴加$\rm H_{2}O_{2}$溶液,若溶液变红$\rm {$或向其中滴加${{\text{K}}_{3}}\left[ \text{Fe}{{\left( \text{CN} \right)}_{6}} \right]$溶液,若产生蓝色沉淀,则溶液中含有$\rm Fe$元素;
“沉锌”过程为向除铜后的滤液中加入$\text{C}{{\text{H}}_{3}}\text{COOH}$和$\text{C}{{\text{H}}_{3}}\text{COONa}$组成的缓冲溶液调节$\rm pH$,然后通入${{\text{H}}_{2}}\text{S}$发生反应:$\text{Z}{{\text{n}}^{2+}}\left( \text{aq} \right)+{{\text{H}}_{2}}\text{S}\left( \text{aq} \right)\rightleftharpoons \text{ZnS}\left( \text{s} \right)+2{{\text{H}}^{+}}\left( \text{aq} \right)$。“沉锌”后溶液中部分微粒浓度见下表:
| 微粒 | ${{\text{H}}_{2}}\text{S}$ | $\text{C}{{\text{H}}_{3}}\text{COOH}$ | $\text{C}{{\text{H}}_{3}}\text{CO}{{\text{O}}^{-}}$ |
| 浓度$\rm /mol·L^{-1}$ | $\rm 0.10$ | $\rm 0.05$ | $\rm 0.10$ |
“沉锌”后溶液的$\text{pH}=$ ,$c\left( \text{Z}{{\text{n}}^{2+}} \right)=$ $\rm \;\rm mol·L^{-1}[$已知常温下:${{K}_{\text{sp}}}\left( \text{ZnS} \right)=2.5\times {{10}^{-22}}$,${{K}_{\text{a}1}}\left( {{\text{H}}_{2}}\text{S} \right)=1.0\times {{10}^{-7}}$,${{K}_{\text{a}2}}\left( {{\text{H}}_{2}}\text{S} \right)=1.0\times {{10}^{-14}}$,${{K}_{\text{a}}}\left( \text{C}{{\text{H}}_{3}}\text{COOH} \right)=2.0\times {{10}^{-5}}\rm ]$。
$\\rm 5$ ; $2.5\\times {{10}^{-10}}$
"]]根据醋酸的电离$\rm CH_{3}COOH⇌CH_{3}COO^{-}+H^{+}$,${{K}_{\text{a}}}\left( \text{C}{{\text{H}}_{\text{3}}}\text{COOH} \right)=\dfrac{c\left( \rm C{{H}_{3}}CO{{O}^{-}} \right)c\left( {{\text{H}}^{+}} \right)}{c\left(\rm C{{H}_{3}}COOH \right)}=\dfrac{0.1\times c\left( {{\text{H}}^{+}} \right)}{0.05}\rm =2.0\times 10^{-5}$,解得$c\left( {{\text{H}}^{+}} \right)\rm =1\times 10^{-5}$ $\rm mol/L$,故$\rm pH=5$;
由$\rm H_{2}S$的两级电离方程式可知,${{K}_{\text{a1}}}\left( {{\text{H}}_{\text{2}}}\text{S} \right)\cdot {{K}_{\text{a2}}}\left( {{\text{H}}_{\text{2}}}\text{S} \right)=\dfrac{{{c}^{2}}\left( {{\text{H}}^{+}} \right)c\left( {{\text{S}}^{2-}} \right)}{c\left( {{\text{H}}_{2}}\text{S} \right)}\rm =10^{-21}$,其中$c\left( {{\text{H}}_{\text{2}}}\text{S} \right)=0.10\text{ mol/L}$,$c\left( {{\text{H}}^{+}} \right)=1\times {{10}^{-5}}\text{ mol/L}$,解得$c\left( {{\text{S}}^{2-}} \right)=1\times {{10}^{-12}}\text{ mol/L}$,再由${{K}_{\text{sp}}}\left( \text{ZnS} \right)=c\left( \text{Z}{{\text{n}}^{2+}} \right)c\left( {{\text{S}}^{2-}} \right)=2.5\times {{10}^{-22}}$,故解得$c\left( \text{Z}{{\text{n}}^{2+}} \right)=2.5\times {{10}^{-10}}\text{ mol/L}$;
$\rm ZnS$是一种优良的锂离子电池负极材料。在充电过程中,负极材料晶胞的组成变化如图所示。
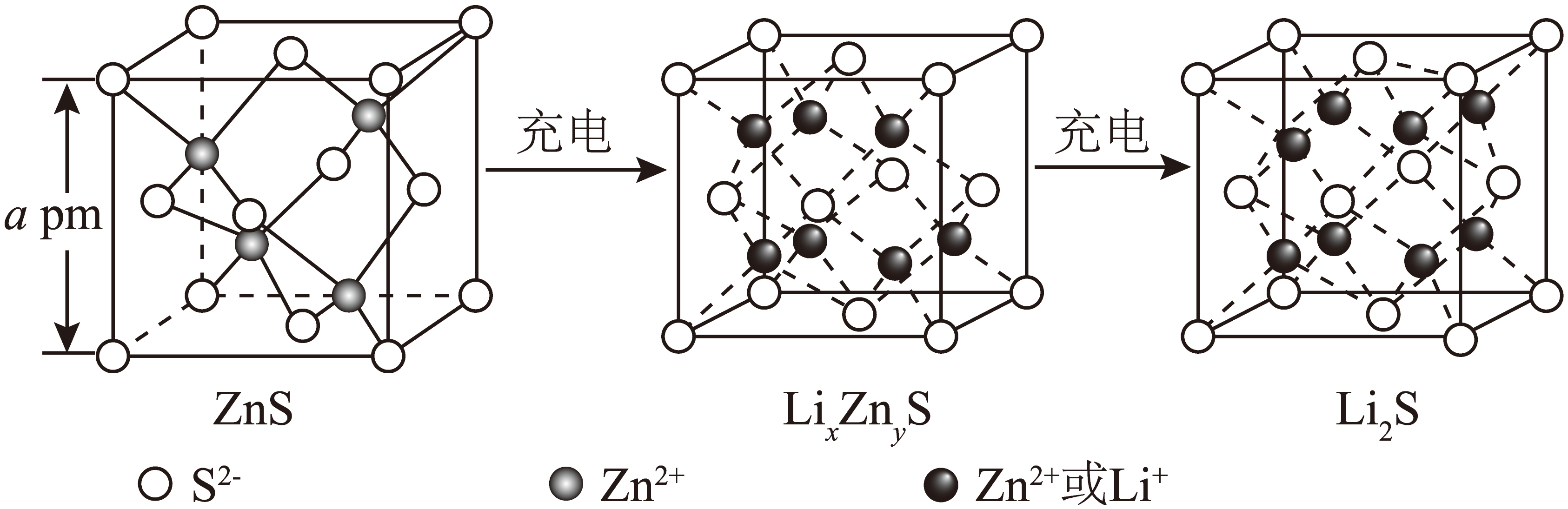
①图示的$\text{L}{{\text{i}}_{x}}\text{Z}{{\text{n}}_{y}}\text{S}$晶胞中$x:y=$ 。
②$\rm ZnS$晶体的摩尔体积${{V}_{\text{m}}}$为 $\rm m^{3}·mol^{-1}$。
$6:1$ ; $\\dfrac{{{a}^{3}}\\times {{10}^{-36}}{{N}_{\\text{A}}}}{4}$
"]]①根据均摊法,图示的$\text{L}{{\text{i}}_{x}}\text{Z}{{\text{n}}_{y}}\text{S}$晶胞中$\rm Li^{+}$和$\rm Zn^{2+}$共有$\rm 7$个,$\rm S^{2-}$有$\rm 4$个,根据化合价代数和为$\rm 0$,$\rm Li^{+}$有$\rm 6$个,$\rm Zn^{2+}$有$\rm 1$个,$x:y=6:1$;
②$\rm ZnS$晶胞中有$\rm 4$个$\rm Zn^{2+}$和$\rm 4$个$\rm S^{2-}$,则$\rm 1$ $\rm mol$晶胞共有$\rm 4$ $\rm mol$ $\rm ZnS$,体积为${{a}^{3}}\times {{10}^{-36}}{{N}_{\text{A}}}\text{ }{{\text{m}}^{3}}$,故每$\rm 1$ $\rm mol$ $\rm ZnS$晶体的体积即$\rm ZnS$晶体的摩尔体积${{V}_{\text{m}}}$为$\dfrac{{{a}^{3}}\times {{10}^{-36}}{{N}_{\text{A}}}}{4}$ $\rm m^{3}·mol^{-1}$。
高中 | 铁盐 亚铁盐题目答案及解析(完整版)
