高中 | 铁盐 亚铁盐 题目答案及解析
稿件来源:高途
高中 | 铁盐 亚铁盐题目答案及解析如下,仅供参考!
必修一
第三章 金属及其化合物
第二节 几种重要的金属化合物
铁盐 亚铁盐
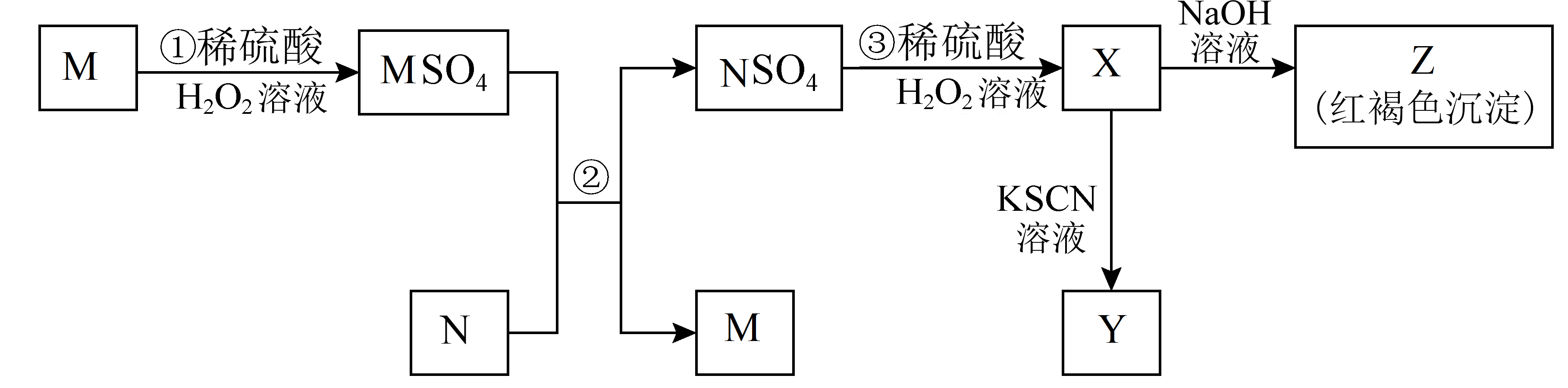
$\rm M$、$\rm N$是日常生活中常见的金属单质,$\rm M$、$\rm N$及其化合物的转化关系$\rm ($每一步反应完全$\rm )$如下图,其中,$\rm X$、$\rm Y$、$\rm Z$是含有元素$\rm N$的化合物,反应②是制备金属$\rm M$的方法之一,下列说法正确的是$\rm (\qquad)$
$\\rm M$、$\\rm N$在常温下都不溶于浓硫酸,因为被钝化
","$\\rm N$的金属性比$\\rm M$强,所以$\\rm N$的所有离子都不能与$\\rm M$反应
","$\\rm 1\\ mol\\ M$在①中完全溶解转移的电子数与$\\rm 1\\ mol\\ NS{{O}_{4}}$在③中完全反应转移的电子数相等
","$\\rm X\\to Y、X\\to Z$的反应都可用来检验$\\rm X$中的金属离子
"]$\rm M$、$\rm N$是日常生活中常见的金属单质,$\rm X$、$\rm Y$、$\rm Z$是含有元素$\rm N$的化合物,根据图中信息可知,$\rm Z$为红褐色沉淀,因此$\rm Z$为$\rm Fe(OH{{)}_{3}}$,$\rm X$中加入$\rm NaOH$溶液后得到$\rm Z$,而$\rm NSO_{4}$中加入稀硫酸和$\rm H_{2}O_{2}$可得到$\rm X$,可知$\rm X$为$\rm F{{e}_{2}}{{(S{{O}_{4}})}_{3}}$,$\rm NSO_{4}$为$\rm FeSO_{4}$,$\rm N$为$\rm Fe$,$\rm X$中加入$\rm KSCN$溶液得到$\rm Y$,则$\rm Y$为$\rm Fe(SCN{{)}_{3}}$;反应②是工业上制备金属$\rm M$的方法之一,可知为湿法炼铜,$\rm M$为$\rm Cu$,$\rm MSO_{4}$为$\rm CuSO_{4}$,据此作答。
$\rm A$.铜在常温下与浓硫酸不反应,与钝化无关,故$\rm A$错误。
$\rm B$.$\rm M$为铜,$\rm N$为铁,铁的金属性比强,$\rm F{{e}^{3+}}$具有强氧化性,能将铜氧化为铜离子,故$\rm B$错误。
$\rm C$.在①中,$\rm Cu$被氧化为$\rm C{{u}^{2+}}$,化合价升高$\rm 2$,$\rm 1\ mol\ Cu$在①中完全溶解转移的电子数为$2N_{\rm A}$,在③中,$\rm FeSO_{4}$被氧化为$\rm F{{e}_{2}}{{(S{{O}_{4}})}_{3}}$,铁的化合价升高$\rm 1$,$\rm 1\ mol\ FeSO_{4}$在③中完全反应转移的电子数为$N_{\rm A}$,两个反应转移电子数不相等,故$\rm C$错误。
$\rm D$.向$\rm F{{e}_{2}}{{(S{{O}_{4}})}_{3}}$溶液中加入$\rm KSCN$生成$\rm Fe(SCN{{)}_{3}}$使溶液呈红色,向$\rm F{{e}_{2}}{{(S{{O}_{4}})}_{3}}$溶液中加入$\rm NaOH$生成$\rm Fe(OH{{)}_{3}}$红褐色沉淀,都可说明存在$\rm F{{e}^{3+}}$,故$\rm D$正确。
故选:$\rm D$
高中 | 铁盐 亚铁盐题目答案及解析(完整版)
