高中 | 铁盐 亚铁盐 题目答案及解析
稿件来源:高途
高中 | 铁盐 亚铁盐题目答案及解析如下,仅供参考!
必修一
第三章 金属及其化合物
第二节 几种重要的金属化合物
铁盐 亚铁盐
$\rm FeSO_{4}$在工业、农业、医药等多个领域有重要应用:
Ⅰ.$\rm FeSO_{4}$可用作植物生长调节剂
盆栽在出现叶片泛黄变焦时可施用$\rm FeSO_{4}$花肥,很多用户因做法不当导致施用后效果不明显,下列做法正确且不影响施用效果的是________。
$\rm A$.为保证肥效,配制较浓溶液浇灌盆栽
$\rm B$.施用$\rm FeSO_{4}$时同时施用碳铵等氮肥以增强肥效
$\rm C$.用自来水配制$\rm FeSO_{4}$溶液进行盆栽灌根
$\rm D$.用$\rm 1\%$柠檬酸水溶液配制$\rm FeSO_{4}$溶液进行盆栽灌根且尽量随用随配
$\\rm D$
"]]$\rm A.$配制较浓溶液浇灌盆栽,$\rm FeSO_{4}$溶液浓度过高,可能会导致土壤溶液浓度过高,使植物细胞失水,出现烧苗现象,影响植物生长,进而影响肥效,$\rm A$不合题意。
$\rm B.FeSO_{4}$中的$\rm Fe^{2+}$会与碳铵等氮肥中的碳酸根离子发生双水解反应,生成氢氧化亚铁,氢氧化亚铁不稳定会被氧化为氢氧化铁,从而降低$\rm FeSO_{4}$的肥效,$\rm B$不合题意。
$\rm C.$自来水中含有氯气等消毒剂,氯气与水反应会生成盐酸和次氯酸,次氯酸具有强氧化性,能将$\rm Fe^{2+}$氧化为$\rm Fe^{3+}$,而植物主要吸收的是$\rm Fe^{2+}$,这样会影响$\rm FeSO_{4}$的肥效,$\rm C$不合题意。
$\rm D.Fe^{2+}$在溶液中易被氧化,柠檬酸具有还原性,可以防止$\rm Fe^{2+}$被氧化,且尽量随用随配也能减少$\rm Fe^{2+}$被氧化的机会,该做法正确且不影响施用效果,$\rm D$符合题意。
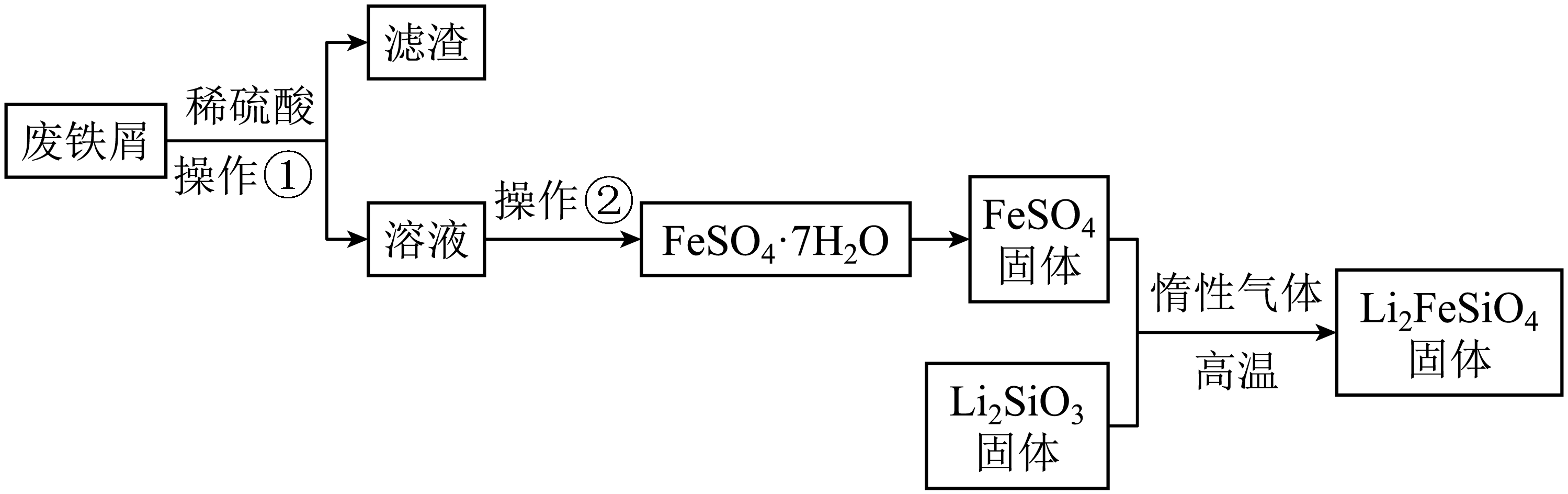
Ⅱ.$\rm FeSO_{4}$可用于制备$\rm Li_{2}FeSiO_{4}$,$\rm Li_{2}FeSiO_{4}$是极具发展潜力的新型锂离子电池电极材料,在手机的几款最新型产品中已经有了一定程度的应用。制备$\rm Li_{2}FeSiO_{4}$的方法为固相法:
$\rm 2 L{{i}_{2}}Si{{O}_{3}}+FeS{{O}_{4}}\begin{matrix} \underline{\underline{惰性气体}} \\高温 \\ \end{matrix}L{{i}_{2}}FeSi{{O}_{4}}+L{{i}_{2}}S{{O}_{4}}+Si{{O}_{2}}$
某学习小组按如下实验流程制备$\rm Li_{2}FeSiO_{4}$并测定所得产品中$\rm Li_{2}FeSiO_{4}$的含量。
实验$\rm ($一$\rm )$制备流程:
实验$\rm ($二$\rm )Li_{2}FeSiO_{4}$含量测定:
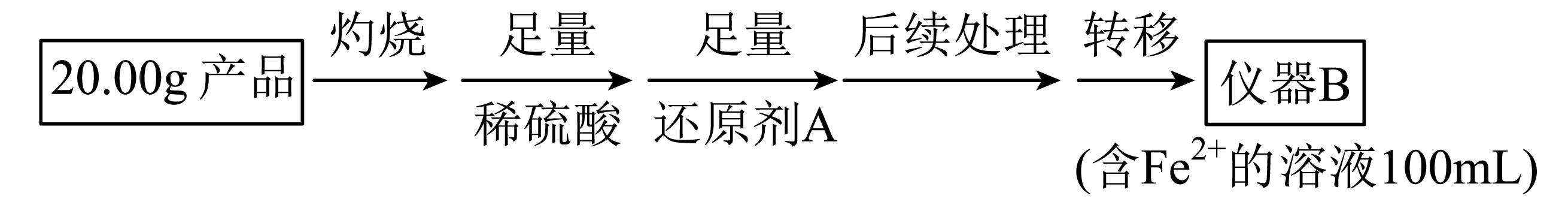
从仪器$\rm B$中取$\rm 20.00\ mL$溶液至锥形瓶中,另取$\rm 0.2000\ mol/L$的酸性$\rm KMnO_{4}$标准溶液装入酸式滴定管中,用氧化还原滴定法测定$\rm Fe^{2+}$含量。相关反应为$\rm MnO_{4}^{-}+5F{{e}^{2+}}+8{{H}^{+}}=M{{n}^{2+}}+5F{{e}^{3+}}+4{{H}_{2}}O$,杂质不与酸性$\rm KMnO_{4}$标准溶液反应。经$\rm 4$次滴定,每次消耗$\rm KMnO_{4}$溶液的体积如下:
| 实验序号 | $\rm 1$ | $\rm 2$ | $\rm 3$ | $\rm 4$ |
| 消耗$\rm KMnO_{4}$溶液体积 | $\rm 20.00\ mL$ | $\rm 20.02\ mL$ | $\rm 21.58\ mL$ | $\rm 19.98\ mL$ |
废铁屑在加稀硫酸溶解前通常要预处理,预处理常用 溶液并加热。
$\\rm NaOH$或$\\rm Na_{2}CO_{3}$
"]]废铁屑表面往往含有油污,阻止废铁屑与稀硫酸接触反应,而油脂在碱性条件下能够完全水解,故在加稀硫酸溶解前通常要预处理,预处理常用$\rm NaOH$或$\rm Na_{2}CO_{3}$溶液并加热,以除去表面油污,加快反应速率。
制备$\rm Li_{2}FeSiO_{4}$时必须在惰性气体氛围中进行,其原因是 。
防止$\\rm Fe^{2+}$被氧化
"]]$\rm Fe^{2+}$易被氧化为$\rm Fe^{3+}$,所以实验制备$\rm Li_{2}FeSiO_{4}$时在惰性气体氛围中进行。
关于上述实验下列说法正确的是________。
$\rm A$.操作①为过滤,为加快过滤速率常用玻璃棒搅拌
$\rm B$.操作②的步骤为蒸发结晶,过滤洗涤
$\rm C$.实验$\rm ($二$\rm )$中称量产品常用托盘天平、药匙等仪器
$\rm D$.滴定时不慎将标准溶液滴过量,可再量取一定量待测液后继续滴定至终点
$\rm E$.滴定读数时,应双手一上一下持滴定管保持垂直且平视读数
$\\rm D$
"]]$\rm A$.由分析可知,操作①为过滤,但过滤时不能玻璃棒搅拌,否则将导致滤纸破损,$\rm A$错误。
$\rm B$.由分析可知,操作②是从$\rm FeSO_{4}$溶液得到$\rm FeSO_{4}\cdot 7H_{2}O$,故操作②的步骤为蒸发浓缩、冷却结晶,过滤洗涤,$\rm B$错误。
$\rm C$.托盘天平的精确度为$\rm 0.1\ g$,故实验$\rm ($二$\rm )$中称量产品常用电子天平或光电天平等精密仪器、药匙等仪器,$\rm C$错误。
$\rm D$.滴定时不慎将标准溶液滴过量,可再量取一定量待测液后继续滴定至终点,这样进行反滴定即可测量出准确值,$\rm D$正确。
$\rm E$.滴定读数时,用双手一上一下持滴定管很难保持垂直状态,应该用一只手的拇指和食指夹住滴定管让其保持自然垂直状态且平视读数,$\rm E$错误。
还原剂$\rm A$可用$\rm SO_{2}$,写出该反应的离子方程式: ,此时后续处理的主要目的是 。
$\\rm 2Fe^{3+}+2H_{2}O+SO_{2}=SO_{4}^{2-}+2Fe^{2+}+4H^{+}$;除去过量的$\\rm SO_{2}$,防止$\\rm SO_{2}$影响$\\rm Fe^{2+}$的测定
"]]还原剂$\rm SO_{2}$的作用是把$\rm Fe^{3+}$还原为$\rm Fe^{2+}$,根据得失电子守恒配平反应方程式是$\rm 2Fe^{3+}+2H_{2}O+SO_{2}=SO_{4}^{2-}+2Fe^{2+}+4H^{+}$,$\rm SO_{2}$具有还原性,能被高锰酸钾氧化,后续处理是除去过量的$\rm SO_{2}$,以免影响$\rm Fe^{2+}$的测定。
根据滴定结果,可确定产品中$\rm Li_{2}FeSiO_{4}$的质量分数为 $\rm ($保留两位有效数字$\rm )$;若滴定前滴定管尖嘴处有气泡,滴定后气泡消失,会使测得的$\rm Li_{2}FeSiO_{4}$含量 $\rm ($填“偏高”、“偏低”或“不变”$\rm )$。
$\\rm 81\\%$;偏高
"]]经$\rm 4$次滴定,第三次实验数据明显偏离正常误差范围,其余$\rm 3$次平均消耗$\rm KMnO_{4}$溶液的体积为$\rm \dfrac{20.00+20.02+19.98}{3}=20.00\ mL$,每次实验消耗高锰酸钾的物质的量是$\rm 0.02\ L\times 0.2\ mol\cdot L^{-1}=0.004\ mol$,根据$\rm MnO_{4}^{-}+5Fe^{2+}+8H^{+}=Mn^{2+}+5Fe^{3+}+4H_{2}O$得关系式$\rm 5L i_{2}FeSiO_{4}\sim KMnO_{4}$,产品中$\rm Li_{2}FeSiO_{4}$的质量分数为$\rm \dfrac{0.004\ mol\times 5\times \dfrac{100\ mL}{20\ mL}\times 162\ g/mol}{20.00\ g}\times 100\%=81\%$,若滴定前滴定管尖嘴处有气泡,滴定后气泡消失,导致标准液$\rm KMnO_{4}$溶液的体积偏大,则会使测得的$\rm Li_{2}FeSiO_{4}$含量偏高。
高中 | 铁盐 亚铁盐题目答案及解析(完整版)
