高中 | 杂化轨道理论 题目答案及解析
稿件来源:高途
高中 | 杂化轨道理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
杂化轨道理论
肼$\rm ({{N}_{2}}{{H}_{4}})$在不同条件下分解产物不同。$\rm 200\ ^\circ \text{C}$时:肼在$\rm Cu$表面分解的机理如图$\rm 1$。肼参与的不同反应过程的能量变化如图$\rm 2$。下列说法正确的是$\rm (\qquad)$
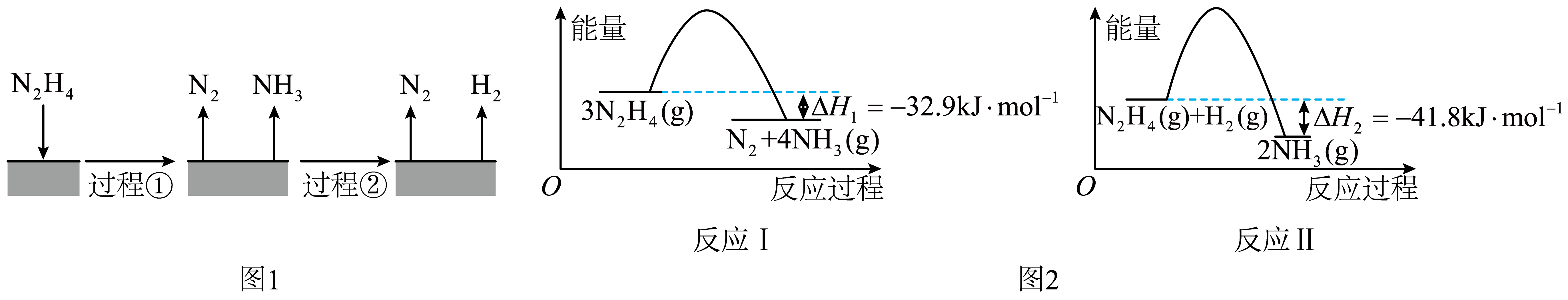
图$\\rm 1$所示过程①、②都是放热反应
","图$\\rm 2$所示反应Ⅰ、Ⅱ都有非极性键的断裂和形成
","$\\rm 200\\ ^\\circ \\text{C}$时,肼分解生成氮气和氢气的热化学方程式为${\\rm {{N}_{2}}{{H}_{4}}(g)={{N}_{2}}(g)+2{{H}_{2}}(g)}\\quad\\Delta H=+50.7\\rm \\ kJ\\cdot mo{{l}^{-1}}$
","以上三种含$\\rm N$物质中,$\\rm N$原子杂化方式均为$\\rm s{{p}^{3}}$杂化
"]$\rm A$.过程②为合成氨的逆反应,是吸热反应,故$\rm A$错误。
$\rm B$.反应Ⅱ没有非极性键的形成,故$\rm B$错误。
$\rm C$.由图$\rm 2$反应Ⅰ可知${\rm 3{{N}_{2}}{{H}_{4}}(g)={{N}_{2}}(g)+4N{{H}_{3}}(g)}\quad \Delta H=-32.9\rm \ kJ\cdot mo{{l}^{-1}}$,反应Ⅱ可知${\rm {{N}_{2}}{{H}_{4}}(g)+{{H}_{2}}(g)=2N{{H}_{3}}(g)}\quad\Delta H=-41.8\rm \ kJ\cdot mo{{l}^{-1}}$,利用盖斯定律反应Ⅰ$\rm -2\times $反应Ⅱ,得${\rm {{N}_{2}}{{H}_{4}}(g)={{N}_{2}}(g)+2{{H}_{2}}(g)}\quad\Delta H=+50.7\rm \ kJ\cdot mo{{l}^{-1}}$,故$\rm C$正确。
$\rm D$.$\rm {{N}_{2}}$中的$\rm N$原子不杂化,故$\rm D$错误。
故选:$\rm C$
高中 | 杂化轨道理论题目答案及解析(完整版)
