高中 | 杂化轨道理论 题目答案及解析
稿件来源:高途
高中 | 杂化轨道理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
杂化轨道理论
活性$\text{F}{{\text{e}}_{3}}{{\text{O}}_{4-x}}$催化反应${\mathrm{H}_{2}(\mathrm{g})+\mathrm{HCO}_{3}^{-}(\mathrm{aq})=\mathrm{HCOO}^{-}(\mathrm{aq})+\mathrm{H}_{2} \mathrm{O}(\mathrm{l})}$的部分机理如图所示。下列说法正确的是$(\qquad)$
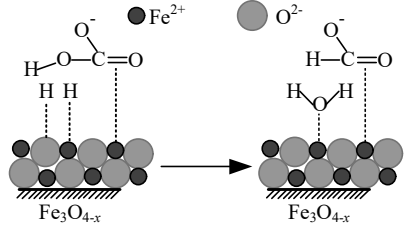
该反应的$\\Delta H\\gt 0$
","该反应平衡常数${K=\\dfrac{c\\left(\\mathrm{HCOO}^{-}\\right)}{c\\left(\\mathrm{HCO}_{3}^{-}\\right)}}$
","反应前后碳原子杂化方式没有发生变化
","吸附在$\\text{F}{{\\text{e}}^{2+}}$表面的$\\mathrm{H}$与$\\text{HCO}_{3}^{-}$中的羟基结合生成水
"]$\rm A$.该自发反应熵减,按$\Delta\!\!\textit{ H}-\textit{T}\ \!\!\Delta\!\!\textit{ S}<\text{0}$可知该反应为放热反应,则$\Delta\!\!\textit{ H}<\text{0}$,$\rm A$错误;
$\rm B$.平衡常数等于生成物浓度系数次方之积与反应物浓度系数次方之积的比;水为纯物质,故反应的平衡常数$K=\dfrac{c\left( \text{HCO}{{\text{O}}^{-}} \right)}{c\left( \text{HCO}_{3}^{-} \right)\cdot c\left( {{\text{H}}_{2}} \right)}$,$\rm B$错误;
$\rm C$.由反应可知,反应前后碳原子均为羧基中碳原子,故碳原子杂化方式始终为$\rm sp^{2}$杂化、杂化方式没有发生变化,$\rm C$正确;
$\rm D$.由图知,吸附在$\text{F}{{\text{e}}^{2+}}$表面的$\mathrm{H}$与$\text{HCO}_{3}^{-}$中的羟基中的氧结合生成水,$\rm D$错误;
故选:$\rm C$
高中 | 杂化轨道理论题目答案及解析(完整版)
