高中 | 杂化轨道理论 题目答案及解析
稿件来源:高途
高中 | 杂化轨道理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
杂化轨道理论
在催化剂作用下$\rm N{{H}_{3}}$可将烟气中的$\rm S{{O}_{2}}$还原为$\rm {{S}_{2}}$,实现变废为宝,反应如下:
反应Ⅰ:${\rm 2N{{H}_{3}}(g)={{N}_{2}}(g)+3{{H}_{2}}(g)}\quad\Delta{{H}_{1}}=+92\rm \ kJ\cdot mo{{l}^{-1}}$
反应Ⅱ:${\rm 3{{H}_{2}}(g)+S{{O}_{2}}(g)=2{{H}_{2}}O(g)+{{H}_{2}}S(g)}\quad\Delta{{H}_{2}}=-2074\rm \ kJ\cdot mo{{l}^{-1}}$
反应Ⅲ:${\rm 4{{H}_{2}}S(g)+2S{{O}_{2}}(g)=3{{S}_{2}}(g)+4{{H}_{2}}O(g)}\quad\Delta{{H}_{3}}=+956\rm \ kJ\cdot mo{{l}^{-1}}$
回答下列问题:
$\rm S{{O}_{2}}$中$\rm S$的杂化方式是 。
$\\rm {sp}^2$
"]]$\rm SO_{2}$的中心$\rm S$原子的价层电子对数为$\rm 2+\dfrac{6-2\times 2}{2}=3$,所以$\rm S{{O}_{2}}$中$\rm S$的杂化方式是$\rm {sp}^2$。
反应Ⅳ:${\rm \dfrac{4}{3}N{{H}_{3}}(g)+S{{O}_{2}}(g)=\dfrac{1}{2}{{S}_{2}}(g)+\dfrac{2}{3}{{N}_{2}}(g)+2{{H}_{2}}O(g) }\quad\Delta{{H}_{4}}=$ $\rm \ kJ\cdot mo{{l}^{-1}}$。
$\\rm -61$
"]]反应$\rm IV=\dfrac{1}{6}\times [(I式+II式)\times 4+III式]$,则由盖斯定律可得:$\Delta {{H}_{4}}=\dfrac{1}{6}\times [ (\Delta{{H}_{1}}+ \Delta{{H}_{2}})\times 4+ \Delta{{H}_{3}}] =\dfrac{1}{6}\times [(92\rm \ kJ\cdot mo{{l}^{-1}}-207.4\ kJ\cdot mo{{l}^{-1}})\times 4+95.6\ kJ\cdot mo{{l}^{-1}}] =-61\ kJ\cdot mo{{l}^{-1}}$。
$\rm 670\ K$、$\rm 20\ MPa$下,向反应器中通入氨气,发生反应Ⅰ。达到平衡后,再向反应器中通入水蒸气稀释,则${{v}_{正}}$ ${{v}_{逆}}($填“$\rm \gt $”、“$\rm \lt $”或“$\rm =$”$\rm )$。依据是 。
$\\rm \\gt $;恒温恒压下,通入水蒸气,平衡向气体分子数增加的方向移动
"]]$\rm 670\ K$、$\rm 20\ MPa$下,向反应器中通入氨气,发生反应Ⅰ。达到平衡后,再向反应器中通入水蒸气稀释,水蒸气不参与反应Ⅰ,恒温恒压下通入不参与反应的气体,容器体积增大,参与反应的气体物质的量不变,各反应组分压强减小,平衡向气体分子数增加的方向移动,因反应$\rm I$是气体分子数增加的反应,即平衡正向移动,则${{v}_{正}}\gt {{v}_{逆}}$,依据是:恒温恒压下,通入水蒸气,平衡向气体分子数增加的方向移动。
$\rm N{{H}_{3}}$和$\rm S{{O}_{2}}$还有另一种反应Ⅴ:$\rm 2N{{H}_{3}}(g)+S{{O}_{2}}(g)={{H}_{2}}S(g)+{{N}_{2}}(g)+2{{H}_{2}}O(g)$。反应Ⅳ、Ⅴ的$\lg{{K}_{\rm p}}$与温度的关系曲线如图。
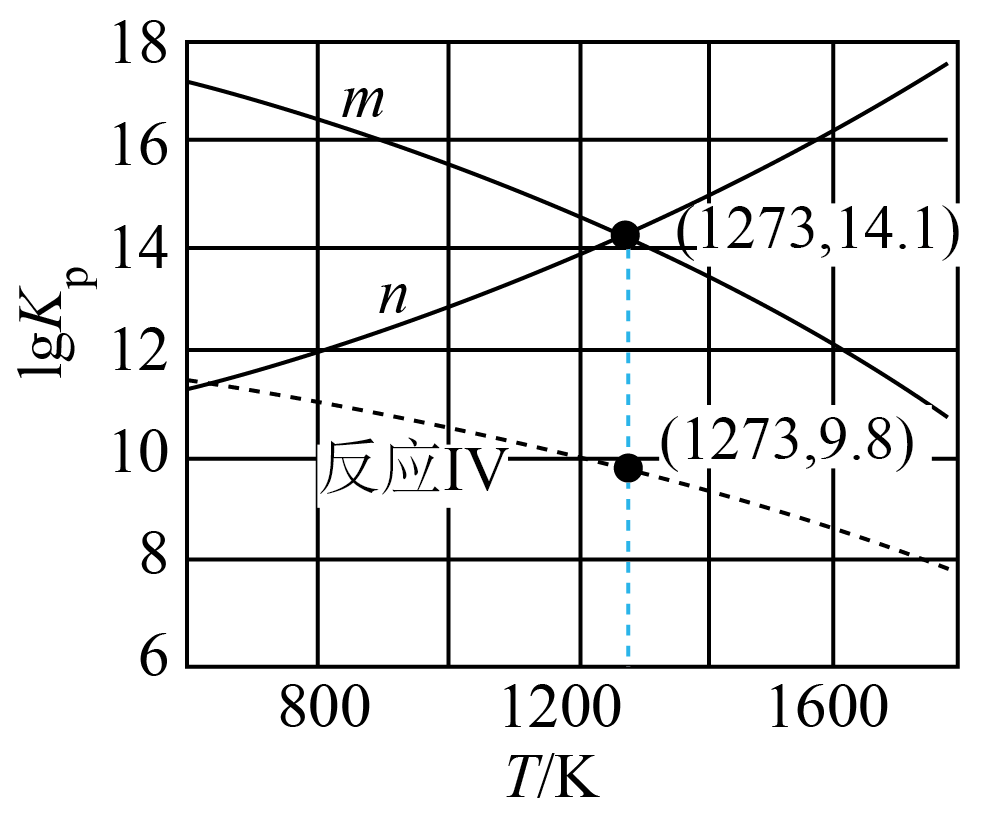
①表示反应Ⅴ的曲线是 $\rm ($填“$m$”或“$n$”$\rm )$。
②反应Ⅲ在$\rm 1273\ K$的$\lg{{K}_{\rm p}}=$ 。
$m$;$\\rm 2.4$
"]]①$\rm V式=I式+II式$,则由盖斯定律得:$\Delta {{H}_{5}}=\Delta {{H}_{1}}+\Delta {{H}_{2}}=92\rm \ kJ\cdot mo{{l}^{-1}}-207.4\ kJ\cdot mo{{l}^{-1}}=-115.4\ kJ\cdot mo{{l}^{-1}}\lt 0$,反应Ⅴ为放热反应,则升高温度,平衡逆向移动,平衡常数$K_{\rm p}$减小,$\lg{{K}_{\rm p}}$也减小,因此表示反应Ⅴ的曲线是$m$。
②由图可知,${{K}_{\rm p,IV}}(1273\ {\rm K})=\dfrac{{{({{p}_{{{\rm S}_{2}}}})}^{\dfrac{1}{2}}}{{({{p}_{{{\rm N}_{2}}}})}^{\dfrac{2}{3}}}{{({{p}_{{{\rm H}_{2}}\rm O}})}^{2}}}{{{({{p}_{\rm N{{H}_{3}}}})}^{\dfrac{4}{3}}}{{p}_{\rm S{{O}_{2}}}}}={{10}^{9.8}}$、${{K}_{\rm p,V}}(1273\ {\rm K})=\dfrac{{{p}_{{{\rm H}_{2}}\rm S}}{{p}_{{{\rm N}_{2}}}}{{({{p}_{{{\rm H}_{2}}\rm O}})}^{2}}}{{{p}_{\rm S{{O}_{2}}}}{{({{p}_{\rm N{{H}_{3}}}})}^{2}}}={{10}^{14.1}}$,则${{ [ {{K}_{\rm p,IV}}(1273\ {\rm K})]}^{6}}=\dfrac{{{({{p}_{{{\rm S}_{2}}}})}^{3}}{{({{p}_{{{\rm N}_{2}}}})}^{4}}{{({{p}_{{{\rm H}_{2}}\rm O}})}^{12}}}{{{({{p}_{\rm N{{H}_{3}}}})}^{8}}{{({{p}_{\rm S{{O}_{2}}}})}^{6}}}={{10}^{9.8\times 6}}$、${{[ {{K}_{\rm p,V}}(1273\ {\rm K})]}^{4}}=\dfrac{{{({{p}_{{\rm {H}_{2}}\rm S}})}^{4}}{{({{p}_{{{\rm N}_{2}}}})}^{4}}{{({{p}_{{{\rm H}_{2}}\rm O}})}^{8}}}{{{({{p}_{\rm S{{O}_{2}}}})}^{4}}{{({{p}_{\rm N{{H}_{3}}}})}^{8}}}={{10}^{14.1\times 4}}$,则反应$\rm III$:${{K}_{\rm p,III}}(1273\ {\rm K})=\dfrac{{{({{p}_{{{\rm S}_{2}}}})}^{3}}{{({{p}_{{{\rm H}_{2}}\rm O}})}^{4}}}{{{({{p}_{{{\rm H}_{2}}\rm S}})}^{4}}{{({{p}_{\rm S{{O}_{2}}}})}^{2}}}=\dfrac{{{ [ {{K}_{\rm p,IV}}\rm (1273\ K)]}^{6}}}{{{ [ {{K}_{\rm p,V}}\rm (1273\ K)]}^{4}}}={{10}^{9.8\times 6-14.1\times 4}}={{10}^{2.4}}$,所以$\lg{{K}_{\rm p,III}}\rm (1273\ K)=2.4$。
研究发现,$\rm N{{H}_{3}}$和$\rm S{{O}_{2}}$在有水蒸气存在下会生成副产物亚硫酸铵和焦亚硫酸铵,查到一部分热力学数据如下:
${\rm {{(N{{H}_{4}})}_{2}}{{S}_{2}}{{O}_{3}}(s)=2N{{H}_{3}}(g)+2S{{O}_{2}}(g)+{{H}_{2}}O(g)}\quad\lg{{K}_{1}}=41.89-17705/T$
${\rm {{(N{{H}_{4}})}_{2}}S{{O}_{3}}(s)=2N{{H}_{3}}(g)+S{{O}_{2}}(g)+{{H}_{2}}O(g)}\quad\lg{{K}_{2}}=32.27-14171/T$
为减少副产物的生成,反应条件应选择 $\rm ($“高温”或“低温”$\rm )$,原因是 。
高温;温度越高,两个反应平衡常数越大,平衡正移,生成亚硫酸铵和焦亚硫酸铵越难进行
"]]根据$\lg K_{1}$、$\lg K_{2}$与$T$的关系式可知,升高温度,$K_{1}$、$K_{2}$均增大,反应均正向进行,则为减少副产物的生成,反应条件应选择高温,原因是:温度越高,两个反应平衡常数越大,平衡正移,生成亚硫酸铵和焦亚硫酸铵越难进行。
高中 | 杂化轨道理论题目答案及解析(完整版)
