高中 | 离子方程式 题目答案及解析
稿件来源:高途
高中 | 离子方程式题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第二节 离子反应
离子方程式
近年来随着新能源汽车的推广使用,产生了大量的废旧三元锂电池,其正极材料主要含铝、锂、镍、钴、锰等元素,某科研团队对正极材料进行回收处理的某种工艺流程如图所示:
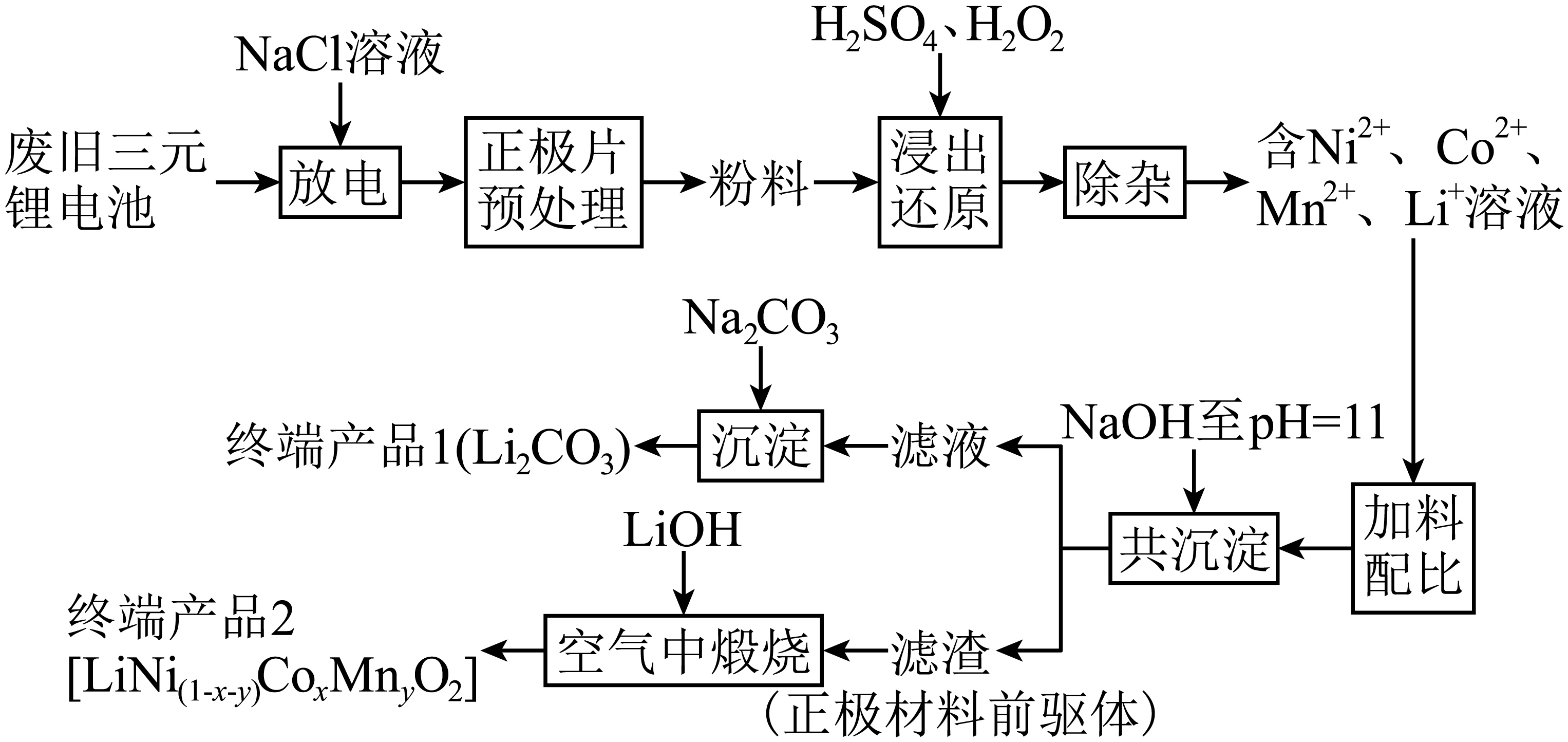
查阅资料显示:碳酸锂的溶解度随温度升高而减小。
回答下列问题:
基态$\rm Mn$原子的简化电子排布式是 。
$\\rm [ Ar ] 3{{d}^{5}}4{{s}^{2}}$
"]]$\rm Mn$是第$\rm 25$号元素,核外电子排布式为:$\rm 1{{s}^{2}}2{{s}^{2}}2{{p}^{6}}3{{s}^{2}}3{{p}^{6}}3{{d}^{5}}4{{s}^{2}}$,故基态$\rm Mn$原子的简化电子排布式是$\rm [ Ar ] 3{{d}^{5}}4{{s}^{2}}$。
回收处理时首先对废旧锂电池进行放电,目的是防止在电池拆解过程中,发生短路引起火灾、爆炸等事故。用$\rm NaCl$溶液浸泡后,放电过程中产生的气体为 。
$\\rm {{H}_{2}}$、$\\rm C{{l}_{2}}$
"]]用$\rm NaCl$溶液浸泡放电的过程为电解$\rm NaCl$溶液的过程,反应方程式为:$\rm 2NaCl+2{{H}_{2}}O\begin{matrix} \underline{\underline{通电}} \\ {} \\\end{matrix}2NaOH+{{H}_{2}}\uparrow +C{{l}_{2}}\uparrow $,故放电过程中产生的气体为$\rm {{H}_{2}}$、$\rm C{{l}_{2}}$。
将正极片预处理得到粉料的目的是 。
增大接触面积,加快反应速率,提高浸出率
"]]将正极片预处理得到粉料的目的是:增大接触面积,加快反应速率,提高浸出率。
粉料中$\rm LiCo{{O}_{2}}($难溶于水$\rm )$参与“浸出还原”反应的氧化剂和还原剂的物质的量之比为 。
$\\rm 2:1$
"]]“浸出还原”的反应式为:$\rm {{H}_{2}}{{O}_{2}}+2\ L\ iCo{{O}_{2}}+6{{H}^{+}}=2\ L{{i}^{+}}+2C{{o}^{2+}}+4{{H}_{2}}O+{{O}_{2}}\uparrow $,故反应的氧化剂$\rm LiCo{{O}_{2}}$和还原剂过氧化氢的物质的量之比为$\rm 2:1$。
在“除杂”阶段,加入$\rm N{{H}_{4}}HC{{O}_{3}}$溶液除去溶液中的$\rm A{{l}^{3+}}$,其反应的离子方程式为 。
$\\rm A{{l}^{3+}}+3HCO_{3}^{-}=Al(OH{{)}_{3}}\\uparrow +3C{{O}_{2}}\\downarrow $
"]]$\rm Al^{3+}$与$\rm HCO_{3}^{-}$发生相互促进的完全双水解反应,其反应的离子方程式为:$\rm A{{l}^{3+}}+3HCO_{3}^{-}=Al(OH{{)}_{3}}\uparrow +3C{{O}_{2}}\downarrow $。
“共沉淀”后的滤液中含有大量$\rm L{{i}^{+}}$,加碳酸钠后,对所得溶液采用如下“系列操作”可得到终端产品$\rm 1$: 、 、洗涤、干燥。
蒸发结晶;趁热过滤
"]]由于碳酸锂的溶解度随温度升高而减小,沉淀完成后从溶液中得到的操作有蒸发结晶、趁热过滤、洗涤、干燥。
某三元锂电池的工作原理如图$\rm 1$所示,两极之间的隔膜只允许$\rm L{{i}^{+}}$通过,电池总反应${\rm L}{{\rm i}_{1-a}}{\rm N}{{\rm i}_{x}}{\rm C}{{\rm o}_{y}}{\rm M}{{\rm n}_{z}}{{\rm O}_{2}}+{\rm L}{{\rm i}_{a}}{{\rm C}_{6}}\overset{放电}{\underset{充电}{\rightleftharpoons}}{\rm LiN}{{\rm i}_{x}}{\rm C}{{\rm o}_{y}}{\rm M}{{\rm n}_{z}}{{\rm O}_{2}}+6\rm C($石墨$\rm )$。放电时,该电池的正极反应式为 。
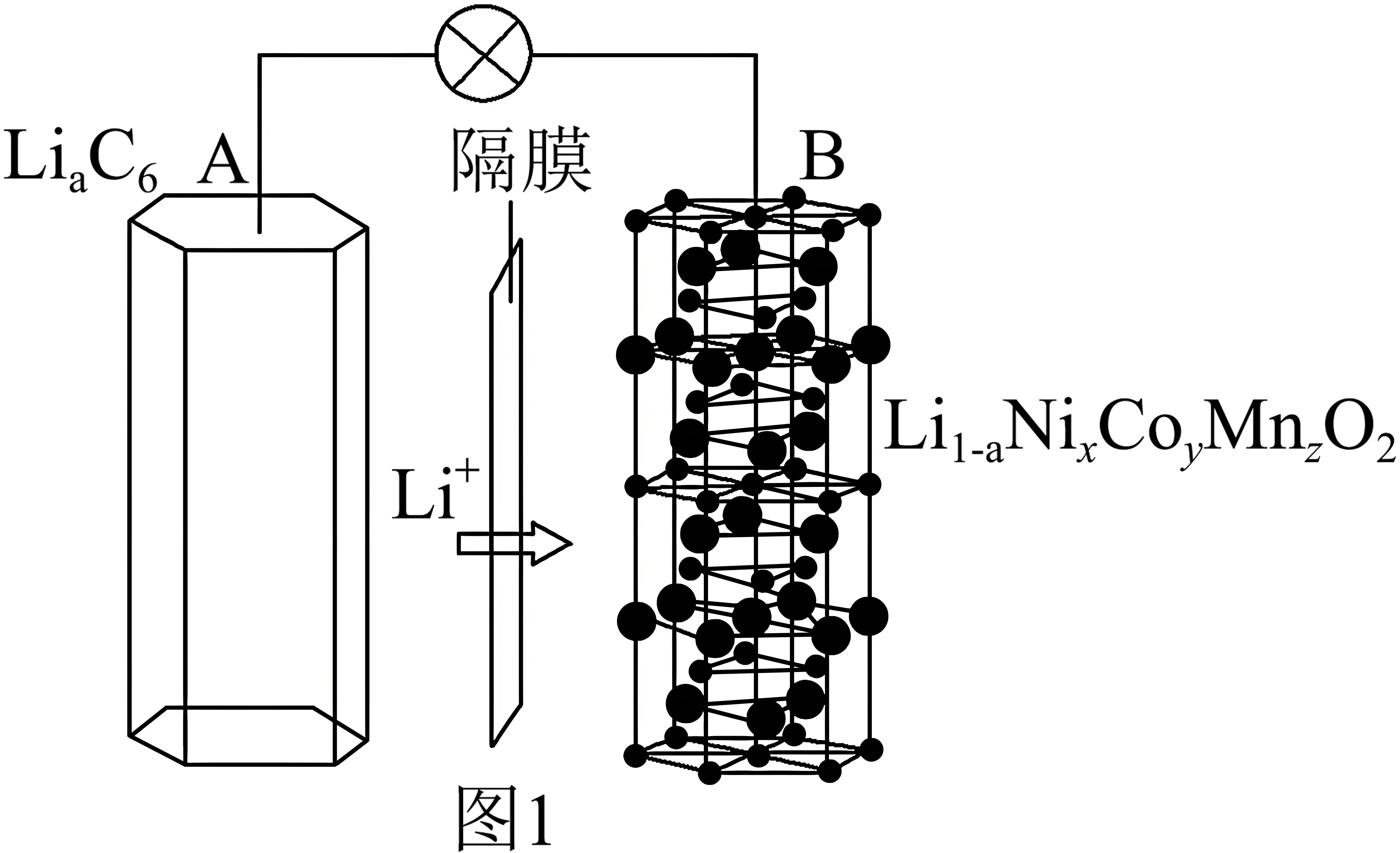
${\\rm L}{{\\rm i}_{1-a}}{\\rm N}{{\\rm i}_{x}}{\\rm C}{{\\rm o}_{y}}{\\rm M}{{\\rm n}_{z}}{{\\rm O}_{2}}+a{\\rm L}{{\\rm i}^{+}}+a{{\\rm e}^{-}}={\\rm LiN}{{\\rm i}_{x}}{\\rm C}{{\\rm o}_{y}}{\\rm M}{{\\rm n}_{z}}{{\\rm O}_{2}}$
"]]总反应为${\rm L}{{\rm i}_{1-a}}{\rm N}{{\rm i}_{x}}{\rm C}{{\rm o}_{y}}{\rm M}{{\rm n}_{z}}{{\rm O}_{2}}+{\rm L}{{\rm i}_{a}}{{\rm C}_{6}}\overset{放电}{\underset{充电}{\rightleftharpoons}}{\rm LiN}{{\rm i}_{x}}{\rm C}{{\rm o}_{y}}{\rm M}{{\rm n}_{z}}{{\rm O}_{2}}+6\rm C($石墨$\rm )$,放电时,${\rm L}{{\rm i}_{1-a}}{\rm N}{{\rm i}_{x}}{\rm C}{{\rm o}_{y}}{\rm M}{{\rm n}_{z}}{{\rm O}_{2}}$在正极得电子被还原,该电池的正极反应式为${\rm L}{{\rm i}_{1-a}}{\rm N}{{\rm i}_{x}}{\rm C}{{\rm o}_{y}}{\rm M}{{\rm n}_{z}}{{\rm O}_{2}}+a{\rm L}{{\rm i}^{+}}+a{{\rm e}^{-}}={\rm LiN}{{\rm i}_{x}}{\rm C}{{\rm o}_{y}}{\rm M}{{\rm n}_{z}}{{\rm O}_{2}}$。
一种钴镍氧化物的立方晶胞结构如图$\rm 2$所示,已知晶胞参数为$a\ \rm pm$,晶胞密度为$\rm \rho\ g\cdot c{{m}^{-3}}$,据此推断阿伏加德罗常数${{N}_{\rm A}}=$ $\rm mo{{l}^{-1}}$。
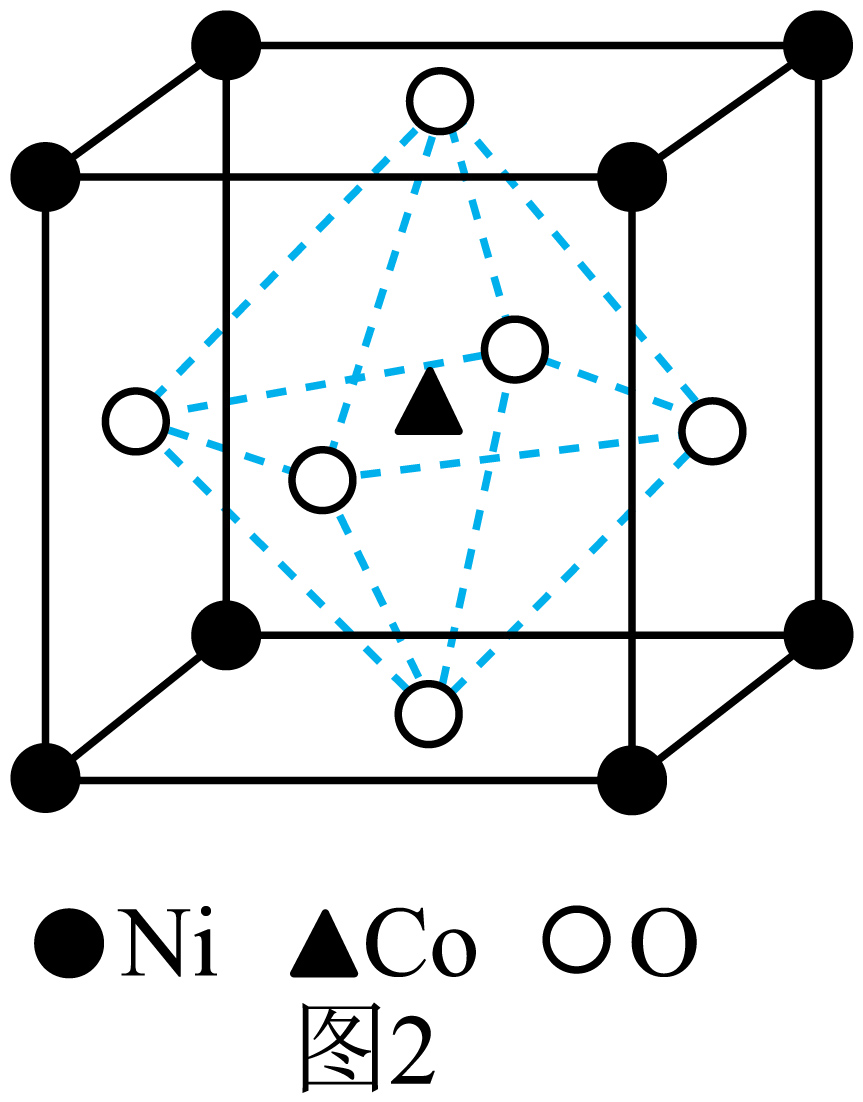
$\\dfrac{166}{\\rho\\times {{a}^{3}}}\\times 1{{0}^{30}}$
"]]该晶胞中$\rm Co$的原子个数为$\rm 1$,$\rm Ni$的原子个数为$\rm \dfrac{1}{8}\times 8=1$,$\rm O$的原子个数为$\rm \dfrac{1}{2}\times 6=3$,故该晶体的化学式为$\rm NiCo{{O}_{3}}$,因为晶胞棱长为$a\ \rm pm$,故晶胞体积为${{(a\times {{10}^{-10}}\ \rm cm)}^{3}}$,晶胞密度为$\rho =\dfrac{59+59+16\times 3}{{{N}_{\rm A}}{{(a\times {{10}^{-10}}\ \rm cm)}^{3}}}\ \rm g\cdot c{{m}^{-3}}$,则${{N}_{\rm A}}=\dfrac{166}{ \rho\times {{a}^{3}}}\times 1{{0}^{30}}\ \rm mo{{l}^{-1}}$。
高中 | 离子方程式题目答案及解析(完整版)
