高中 | 杂化轨道理论 题目答案及解析
稿件来源:高途
高中 | 杂化轨道理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
杂化轨道理论
丙烯腈$\left( \text{C}{{\text{H}}_{2}}=\text{CHCN} \right)$是一种无色有刺激性气味的有机液体,作为一种重要的化工原料,在合成纤维领域中有着广泛的应用。回答下列问题:
$\rm I$.以$\rm 3-$羟基丙酸乙酯$\rm ($![]() $\rm )$为原料合成丙烯腈的主要反应如下:
$\rm )$为原料合成丙烯腈的主要反应如下:
反应$\rm 1$: ![]() $\quad \Delta {{H}_{\text{2}}}$
$\quad \Delta {{H}_{\text{2}}}$
反应$\rm 2$:![]() $\text{C}{{\text{H}}_{3}}\text{C}{{\text{H}}_{2}}\text{OH}\left( \text{g} \right)\quad \Delta {{H}_{\text{2}}}$
$\text{C}{{\text{H}}_{3}}\text{C}{{\text{H}}_{2}}\text{OH}\left( \text{g} \right)\quad \Delta {{H}_{\text{2}}}$
根据下表数据计算$\Delta {{H}_{\text{1}}}=$ 。
| 化学键 | $\text{C}-\text{O}$ | $\text{C}-\text{C}$ | $\text{C}=\text{C}$ | $\text{C}-\text{H}$ | $\text{O}-\text{H}$ | $\text{C}=\text{O}$ |
| 键能$\text{/}\left( \text{kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}} \right)$ | $\rm 351$ | $\rm 348$ | $\rm 615$ | $\rm 413$ | $\rm 463$ | $\rm 745$ |
$\\rm +34$ $\\rm kJ\\cdot mol^{-1}$
"]]焓变$\rm =$反应物总键能$\rm -$生成物总键能,$\Delta {{H}_{1}}=\left( 463+413\times 9+351\times 3+348\times 3+745 \right)\,\text{kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}-\left( 413\times 8+615+745+351\times 2+348\times 2+463\times 2 \right)\,\text{kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}=+34\,\text{kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$;
$\rm I$$\rm I$.工业上还可用“丙烯氨氧化法”制备丙烯腈,以丙烯、氨气和氧气为原料,在催化剂作用下制备丙烯腈的主要反应如下:
反应$ 1\ {{\text{C}}_{3}}{{\text{H}}_{6}}\left( \text{g} \right)+\text{N}{{\text{H}}_{3}}\left( \text{g} \right)+\dfrac{3}{2}{{\text{O}}_{2}}\left( \text{g} \right)\rightleftharpoons \text{C}{{\text{H}}_{2}}=\text{CHCN}\left( \text{g} \right)+3{{\text{H}}_{2}}\text{O}\left( \text{g} \right)\quad \Delta {{H}_{1}}=-515\ \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
反应$ 2\ {{\text{C}}_{3}}{{\text{H}}_{6}}\left( \text{g} \right)+{{\text{O}}_{2}}\left( \text{g} \right)\rightleftharpoons \text{C}{{\text{H}}_{2}}=\text{CHCHO}\left( \text{g} \right)+{{\text{H}}_{2}}\text{O}\left( \text{g} \right)\quad \Delta {{H}_{2}}=-353\ \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
首先需合成原料氨气,在反应${{\text{N}}_{2}}\left( \text{g} \right)+3{{\text{H}}_{2}}\left( \text{g} \right)\rightleftharpoons 2\text{N}{{\text{H}}_{3}}\left( \text{g} \right)\quad \Delta H\lt 0$ 中,${{v}_{正}}={{k}_{正}}c\left( {{\text{N}}_{2}} \right)\cdot {{c}^{3}}\left( {{\text{H}}_{2}} \right)$,${{v}_{逆}}={{k}_{逆}}{{c}^{2}}\left( \text{N}{{\text{H}}_{3}} \right)$,${{k}_{正}}$、${{k}_{逆}}$为速率常数。正反应和逆反应的平衡常数与温度的关系如图$\rm 1$所示。表示逆反应的平衡常数与温度变化关系的曲线为 $\rm ($填“${{\text{L}}_{\text{1}}}$”或“${{\text{L}}_{\text{2}}}$”$\rm )$,${{T}_{0}}\rm ^\circ\rm C$时,$\dfrac{{{k}_{正}}}{{{k}_{逆}}}=$ 。
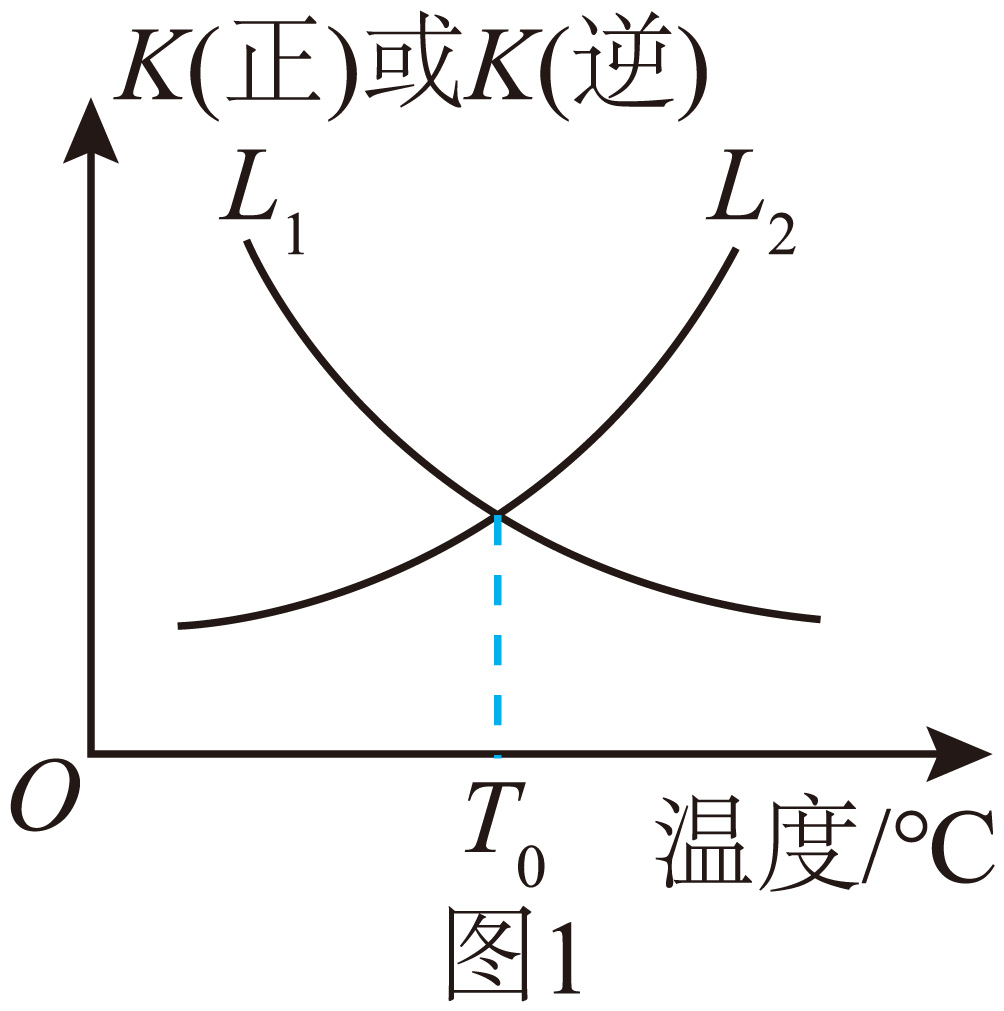
$\\rm L_{2}$ ; $\\rm 1$
"]]该反应为放热反应,升高温度平衡逆向移动,逆反应平衡常数增大,则$\rm L_{2}$表示逆反应的平衡常数与温度变化关系,${{T}_{0}}\text{ }{}^\circ \text{C}$时,正逆平衡常数相等,即$K(正)=K(逆)=1$,平衡时:${{v}_{正}}={{v}_{逆}}$,即${{k}_{正}}\cdot c\left( {{\text{N}}_{\text{2}}} \right)\cdot {{c}^{3}}\left( {{\text{H}}_{\text{2}}} \right)={{k}_{逆}}\cdot {{c}^{2}}\left( \text{N}{{\text{H}}_{\text{3}}} \right)$, $\dfrac{{{k}_{正}}}{{{k}_{逆}}}=\dfrac{{{c}^{\text{2}}}\left( \text{N}{{\text{H}}_{\text{3}}} \right)}{c({{\text{N}}_{\text{2}}})\cdot {{c}^{\text{3}}}({{\text{H}}_{\text{2}}})}={{K}_{正}}=1$;
反应$\rm 1$在 $\rm ($填“高温”“低温”或“任意温度”$\rm )$下可自发进行;恒温恒容条件下,若容器内只发生反应$\rm 1$,下列能表明反应已经达到平衡状态的是 $\rm ($填字母$\rm )$。
$\rm A$.容器内混合气体的密度不再变化
$\rm B$.断裂$1\ \text{mol}\,\text{N}-\text{H}$的同时断裂$\text{3}\,\text{mol}\,\text{O-H}$
$\rm C$.容器内压强不再变化
$\rm D$.$3{{v}_{正}}\left( \text{N}{{\text{H}}_{3}} \right)=2{{v}_{逆}}\left( {{\text{O}}_{2}} \right)$
任意温度 ; $\\rm CD$
"]]反应$\rm 1$的$\Delta H\lt 0$,$\Delta S\gt 0$,$\Delta G=\Delta H-T\Delta S$始终小于$\rm 0$,则在任意温度下都能自发进行;
$\rm A$.容器恒容,密度始终不变,容器内混合气体的密度不再变化不能说明达到平衡,故$\rm A$不选;
$\rm B$.断裂$1\ \text{mol}\,\text{N}-\text{H}$的同时断裂$\text{3}\,\text{mol}\,\text{O-H}$,正逆反应速率不等,没有达到平衡,应该是断裂$1\ \text{mol}\,\text{N}-\text{H}$的同时断裂$\text{2}\,\text{mol}\,\text{O-H}$,反应才平衡,故$\rm B$不选;
$\rm C$.该反应是气体分子数变大的反应,如果没有平衡,向右进行时则压强增大,现压强不变可以说明达到平衡,故$\rm C$选;
$\rm D$.$3{{v}_{正}}\left( \text{N}{{\text{H}}_{3}} \right)=2{{v}_{逆}}\left( {{\text{O}}_{2}} \right)$,速率之比等于计量数之比,反应达到平衡,故$\rm D$选;
在温度为${{T}_{1}}\text{ }{}^\circ \text{C}$和压强为$28\,\text{MPa}$条件下,向恒压密闭容器中充入$1\ \text{mol}\,\text{C}{{\text{H}}_{2}}=\text{CHC}{{\text{H}}_{3}}$、$1\ \text{mol}\,\text{N}{{\text{H}}_{3}}$和$4.8\ \text{mol}\,{{\text{O}}_{2}}$发生上述两个反应,容器内${{\text{H}}_{2}}\text{O}\left( \text{g} \right)$、$\text{C}{{\text{H}}_{2}}=\text{CHCN}\left( \text{g} \right)$、$\text{C}{{\text{H}}_{2}}=\text{CHC}{{\text{H}}_{3}}\left( \text{g} \right)$的物质的量$ (n\rm )$随时间$ (t\rm )$的变化关系如图$\rm 2$所示。图中表示$\text{C}{{\text{H}}_{2}}=\text{CHCN}\left( \text{g} \right)$的曲线是 $\rm ($填“$\rm I$”“$\rm II$”或“$\rm III$”$\rm )$。反应$\rm 2$的压强平衡常数${{K}_{\text{p}}}=$ $({{K}_{\text{p}}}$为用分压表示的平衡常数,分压$\rm =$总压$\rm \times $物质的量分数$\rm )$。
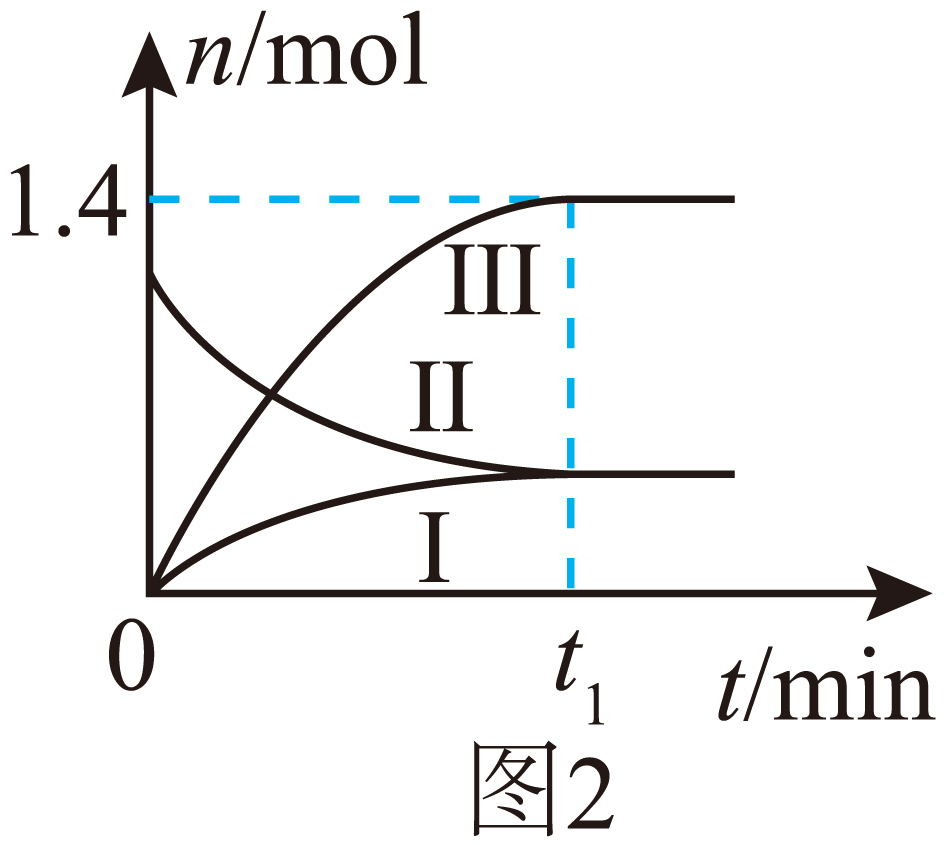
$\\rm I$ ; $\\dfrac{7}{40}$
"]]根据两个反应方程式:
反应$\rm 1{{\text{C}}_{3}}{{\text{H}}_{6}}\left( \text{g} \right)+\text{N}{{\text{H}}_{3}}\left( \text{g} \right)+\dfrac{3}{2}{{\text{O}}_{2}}\left( \text{g} \right)\rightleftharpoons \text{C}{{\text{H}}_{2}}=\text{CHCN}\left( \text{g} \right)+3{{\text{H}}_{2}}\text{O}\left( \text{g} \right)$
反应$\rm 2{{\text{C}}_{3}}{{\text{H}}_{6}}\left( \text{g} \right)+{{\text{O}}_{2}}\left( \text{g} \right)\rightleftharpoons \text{C}{{\text{H}}_{2}}=\text{CHCHO}\left( \text{g} \right)+{{\text{H}}_{2}}\text{O}\left( \text{g} \right)$
两个反应均正向进行,$\rm H_{2}O$增加的量最大,即曲线$\rm III$表示$\rm H_{2}O$,曲线$\rm II$表示$\rm C_{3}H_{6}$,曲线$\rm I$表示$\text{C}{{\text{H}}_{2}}=\text{CHCN}\left( \text{g} \right)$,假设反应$\rm 1$消耗$\rm C_{3}H_{6}$为$x\,\text{mol}$,反应$\rm 2$消耗$\rm C_{3}H_{6}$为$y\,\text{mol}$,则有:
$\begin{matrix} {} & \text{N}{{\text{H}}_{\text{3}}}\left( \text{g} \right)+ & {{\text{C}}_{\text{3}}}{{\text{H}}_{\text{6}}}\left( \text{g} \right)+ & \dfrac{\text{3}}{\text{2}}{{\text{O}}_{\text{2}}}\left( \text{g} \right) & \rightleftharpoons & \text{C}{{\text{H}}_{\text{2}}}\text{=CHCN}\left( \text{g} \right) & \text{+3}{{\text{H}}_{\text{2}}}\text{O}\left( \text{g} \right) \\变化 \text{(mol)} & {x} & x & \dfrac{3}{2}x & {} & x & 3x \\ \end{matrix}$
$\begin{matrix} {} & {{\text{C}}_{\text{3}}}{{\text{H}}_{\text{6}}}\left( \text{g} \right)+ & {{\text{O}}_{\text{2}}}\left( \text{g} \right) & \rightleftharpoons & \text{C}{{\text{H}}_{\text{2}}}\text{=CHCHO}\left( \text{g} \right) & +{{\text{H}}_{\text{2}}}\text{O}\left( \text{g} \right) \\变化 \text{(mol)} & y & y & {} & y & y \\ \end{matrix}$
根据题意有$3x+y=1.4$,$1-x-y=x$,解得$x=0.4$,$y=0.2$,平衡时$n\left( {{\text{C}}_{\text{3}}}{{\text{H}}_{\text{6}}} \right)=0.4\,\text{mol}$,$n\left( \text{N}{{\text{H}}_{\text{3}}} \right)=1-0.4=0.6\,\text{mol}$,$n\left( {{\text{O}}_{\text{2}}} \right)=4.8-0.6-0.2=4\,\text{mol}$, $n(\text{C}{{\text{H}}_{2}}=\text{CHCN})=0.4\,\text{mol}$,$n\left( {{\text{H}}_{\text{2}}}\text{O} \right)=1.4\,\text{mol}$, $n(\text{C}{{\text{H}}_{2}}=\text{CHCHO})=0.2\,\text{mol}$,$n总=7.0\,\text{mol}$,反应$\rm 2$的压强平衡常数${{K}_{p}}=\dfrac{p({{\text{H}}_{\text{2}}}\text{O})p(\text{C}{{\text{H}}_{2}}=\text{CHCHO})}{p({{\text{C}}_{\text{3}}}{{\text{H}}_{6}})p\text{(}{{\text{O}}_{\text{2}}}\text{)}}=\dfrac{28\times \dfrac{1.4}{7}\times 28\times \dfrac{0.2}{7}}{28\times \dfrac{0.4}{7}\times 28\times \dfrac{4}{7}}=\dfrac{7}{40}$;
$\rm II$$\rm I$.利用电解法由丙烯腈制备己二腈$\left[ \text{NC}{{\left( \text{C}{{\text{H}}_{2}} \right)}_{4}}\text{CN} \right]$的装置示意图如图$\rm 3$所示。
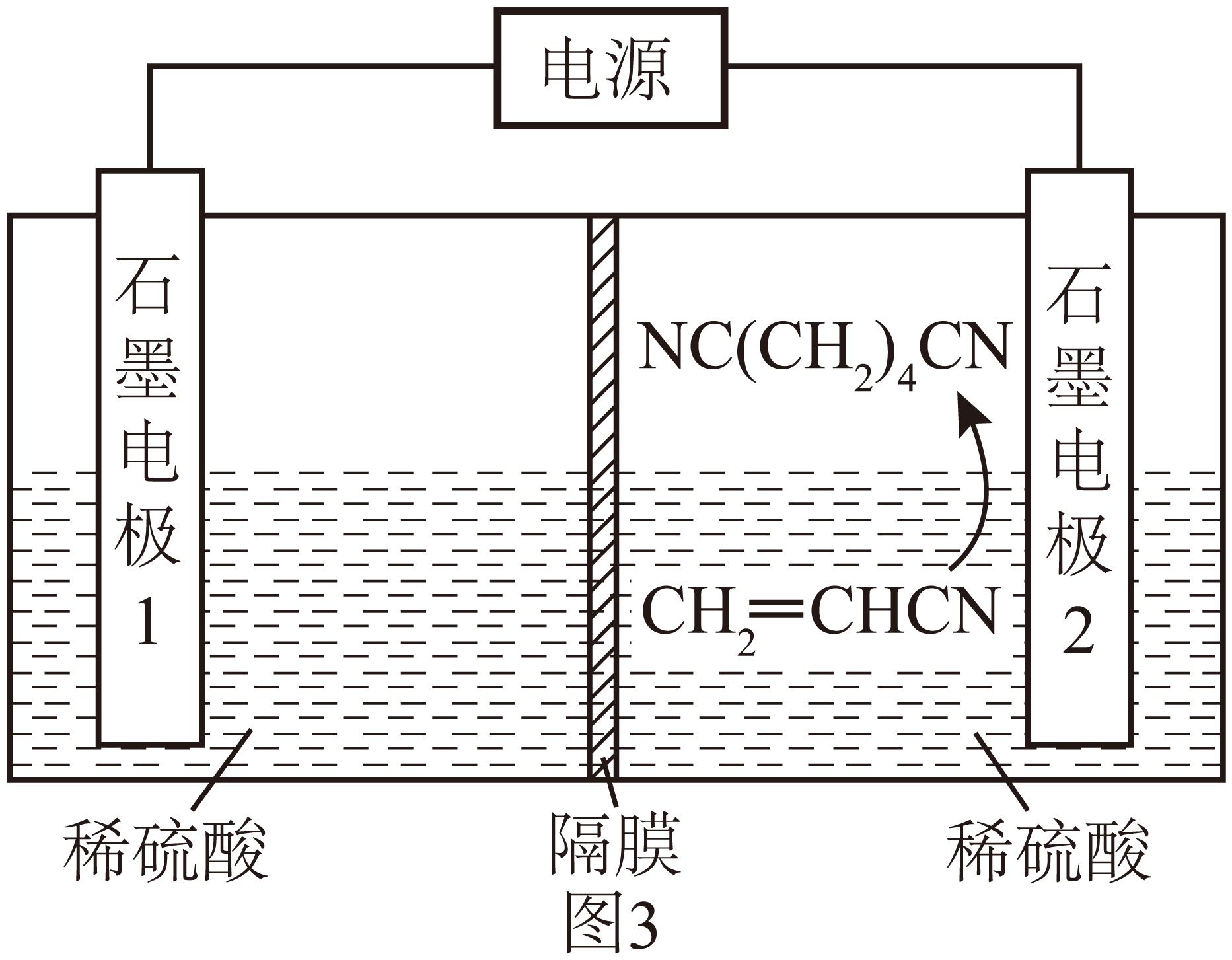
通电过程中,石墨电极$\rm 2$上的电极反应为 。
$\\rm 2CH_{2}=CHCN+2e^{-}+2H^{+}=NC(CH_{2})_{4}CN$
"]]根据图示,石墨电极$\rm 2$上$\rm CH_{2}=CHCN$ 发生还原反应生成$\rm NC(CH_{2})_{4}CN$,石墨电极$\rm 2$上极反应式为$\rm 2CH_{2}=CHCN+2e^{-}+2H^{+}=NC(CH_{2})_{4}CN$
$\text{C}{{\text{H}}_{2}}=\text{CHCN}$转化为$\text{NC}{{\left( \text{C}{{\text{H}}_{2}} \right)}_{4}}\text{CN}$过程中,$\rm C$原子的杂化轨道类型是否发生变化? $\rm ($填“是”或“否”$\rm )$。
是
"]]$\text{C}{{\text{H}}_{2}}=\text{CHCN}$中$\rm C$原子的杂化类型为$\rm sp$和$\rm sp^{2}$,$\text{NC}{{\left( \text{C}{{\text{H}}_{2}} \right)}_{4}}\text{CN}$中$\rm C$原子的杂化类型为$\rm sp$和$\rm sp^{3}$,杂化方式发生了变化。
高中 | 杂化轨道理论题目答案及解析(完整版)
