高中 | 杂化轨道理论 题目答案及解析
稿件来源:高途
高中 | 杂化轨道理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
杂化轨道理论
阅读下面材料,完成下面小题。
第二周期元素及其化合物应用广泛。锂可用作电极材料;铍和铝性质相似,$\rm BeO$可用于制作坩埚;氨硼烷$\rm (NH_{3}BH_{3})$是一种固体储氢材料,可与水在催化剂作用下生成$\rm (NH_{4})_{3}B_{3}O_{6}$和$\rm H_{2}$,碳能形成多种氧化物,金星大气层中含有的$\rm C_{2}O_{3}$能与$\rm H_{2}O$反应生成$\rm H_{2}C_{2}O_{4}$,$\rm H_{2}C_{2}O_{4}$是二元弱酸,有还原性,可与多种金属离子形成沉淀或络合物;聚四氟乙烯材料可制作酸碱通用滴定管的活塞及化工反应器的内壁涂层。
下列有关物质结构与性质的说法不正确的是$\rm (\qquad)$
$\\rm NH_{3}BH_{3}$分子中存在配位键,$\\rm N$原子提供孤电子对
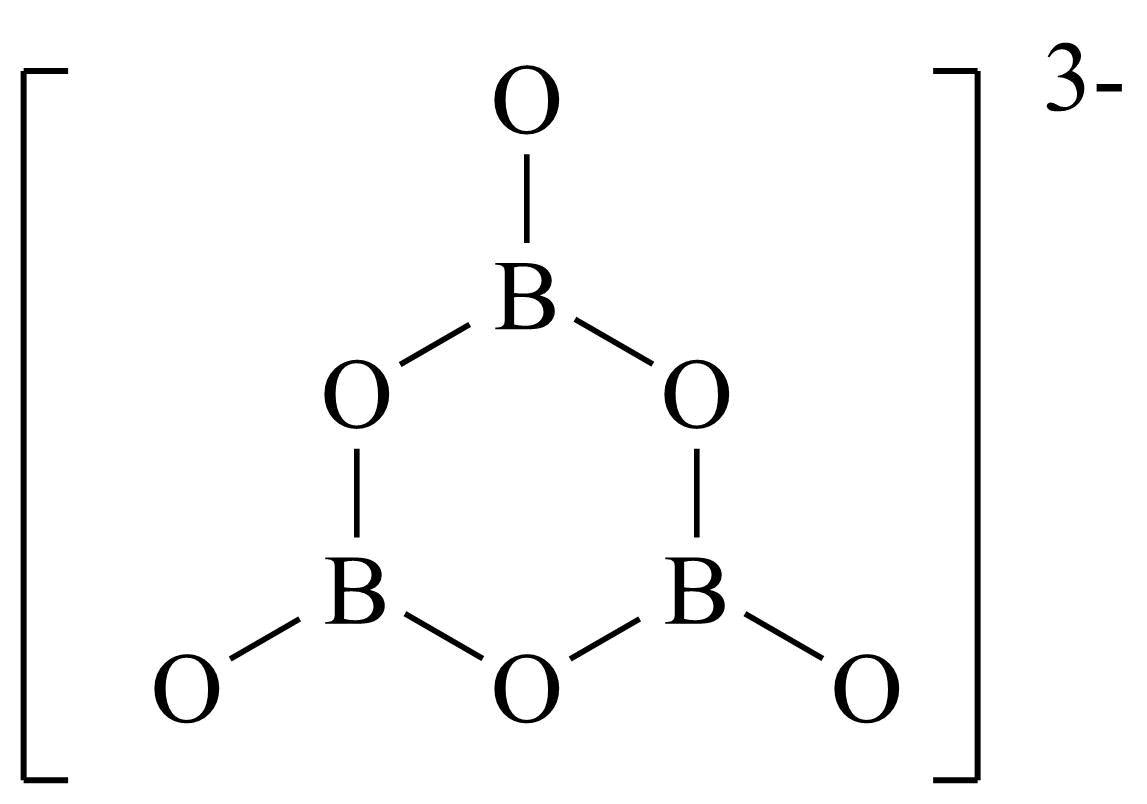
","$\\rm {{\\text{B}}_{3}}\\text{O}_{6}^{3-}\\rm ($结构如图$\\rm )$中$\\rm B$原子、$\\rm O$原子均采用$\\rm sp^{3}$杂化
","$\\rm NH_{3}BH_{3}$中与氮原子相连的氢带部分正电荷,与硼原子相连的氢带部分负电荷
","$\\rm CH_{3}CH_{3}$与$\\rm NH_{3}BH_{3}$的原子总数、电子总数均相等,熔点比$\\rm NH_{3}BH_{3}$低
"]$\rm A$.已知$\rm B$的最外层上只有$\rm 3$个电子,而$\rm N$原子最外层上有$\rm 5$个电子,故$\rm NH_{3}BH_{3}$分子中存在配位键,$\rm N$原子提供孤电子对,$\rm A$正确;
$\rm B$.由题干$\rm {{\text{B}}_{3}}\text{O}_{6}^{3-}$结构图可知$\rm B$原子周围的价层电子对数为$\rm 3+\dfrac{3-3\times 1}{2}=3$,故采用$\rm sp^{2}$杂化、$\rm O$原子周围的价层电子数为$\rm 2+\dfrac{6-2\times 1}{2}=4$,则采用$\rm sp^{3}$杂化,$\rm B$错误;
$\rm C$.已知两元素形成化学键时电负性大的一方显负电性,电负性$\rm N\gt H\gt B$,则$\rm NH_{3}BH_{3}$中与氮原子相连的氢带部分正电荷,与硼原子相连的氢带部分负电荷,$\rm C$正确;
$\rm D$.$\rm CH_{3}CH_{3}$与$\rm NH_{3}BH_{3}$的原子总数、电子总数均相等,由于$\rm NH_{3}BH_{3}$分子间能够形成氢键,导致其熔沸点反常升高,即$\rm CH_{3}CH_{3}$的熔点比$\rm NH_{3}BH_{3}$低,$\rm D$正确;
故选:$\rm B$
高中 | 杂化轨道理论题目答案及解析(完整版)
