高中 | 核素 题目答案及解析
稿件来源:高途
高中 | 核素题目答案及解析如下,仅供参考!
必修二
第一章 物质结构 元素周期律
第一节 元素周期表
核素
第Ⅴ$\rm A$族氮、磷元素及其化合物应用广泛。氨是重要的化工原料。磷元素可以形成白磷、红磷和黑磷等三种常见的单质。黑磷具有与石墨类似的层状结构。白磷和红磷转化的热化学方程式为$ x\rm P_{4}$ $\rm ($白磷,$\rm s)=4P_{\textit{x}}$ $\rm ($红磷,$\rm s)$$\qquad\Delta H\lt0$;实验室常用$\text{CuS}{{\text{O}}_{4}}$溶液吸收有毒气体$\text{P}{{\text{H}}_{3}}$,生成${{\text{H}}_{3}}\text{P}{{\text{O}}_{4}}$、${{\text{H}}_{2}}\text{S}{{\text{O}}_{4}}$和$\rm Cu$。磷元素可形成多种含氧酸,其中次磷酸$\left( {{\text{H}}_{3}}\text{P}{{\text{O}}_{2}} \right)$为一元弱酸;磷酸可与铁反应,在金属表面生成致密且难溶于水的磷酸盐膜。
白磷$\left( {{\text{P}}_{4}} \right)$分子结构及晶胞如下图所示,下列说法正确的是$(\quad\ \ \ \ )$
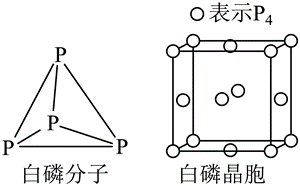
${{\\text{P}}_{4}}$分子中的$\\rm P-P-P$键角为$\\rm 60^\\circ$
","白磷和红磷互为同位素
","白磷晶体中$\\rm 1$个${{\\text{P}}_{4}}$分子周围有$\\rm 8$个紧邻的${{\\text{P}}_{4}}$分子
","白磷和红磷在${{\\text{O}}_{2}}$中充分燃烧生成等量${{\\text{P}}_{\\text{2}}}{{\\text{O}}_{\\text{5}}}\\left(\\text{s} \\right)$,红磷放出的热量更多
"]$\rm A$.白磷分子为正四面体结构,每个顶点$\rm 1$个$\rm P$原子,$\rm P_{4}$分子中的$\rm P-P-P$键角为$\rm 60^\circ$,$\rm A$正确;
$\rm B$.白磷和红磷互为同素异形体,$\rm B$错误;
$\rm C$.白磷为面心立方最密堆积,配位数为$\rm 12$,白磷晶体中$\rm 1$个$\rm P_{4}$分子周围有$\rm 12$个紧邻的$\rm P_{4}$分子,$\rm C$错误;
$\rm D$.从题中可知,白磷转化为红磷放热,说明相等质量的白磷能量高于红磷,白磷和红磷在氧气中充分燃烧生成等量的$\rm P_{2}O_{5}(s)$,白磷放出的能量更多,$\rm D$错误;
故选:$\rm A$
下列化学反应表示正确的是$(\quad\ \ \ \ )$
用氨水和$\\text{AlC}{{\\text{l}}_{3}}$溶液制备$\\text{Al}{{\\left( \\text{OH} \\right)}_{3}}$:$\\text{A}{{\\text{l}}^{3+}}+3\\text{O}{{\\text{H}}^{-}}=\\text{Al}{{\\left(\\text{OH} \\right)}_{3}}\\downarrow $
","工业上用足量氨水吸收$\\text{S}{{\\text{O}}_{2}}$:$\\text{N}{{\\text{H}}_{3}}\\cdot {{\\text{H}}_{2}}\\text{O}+\\text{S}{{\\text{O}}_{2}}=\\text{N}{{\\text{H}}_{4}}\\text{HS}{{\\text{O}}_{3}}$
","用$\\text{CuS}{{\\text{O}}_{4}}$溶液吸收$\\text{P}{{\\text{H}}_{3}}$:$\\text{P}{{\\text{H}}_{3}}+4\\text{CuS}{{\\text{O}}_{4}}+4{{\\text{H}}_{2}}\\text{O}=4\\text{Cu}\\downarrow+{{\\text{H}}_{3}}\\text{P}{{\\text{O}}_{4}}+4{{\\text{H}}_{2}}\\text{S}{{\\text{O}}_{4}}$
","次磷酸与足量 $\\rm NaOH$溶液反应:${{\\text{H}}_{3}}\\text{P}{{\\text{O}}_{2}}+3\\text{NaOH}=\\text{N}{{\\text{a}}_{3}}\\text{P}{{\\text{O}}_{2}}+3{{\\text{H}}_{2}}\\text{O}$
"]$\rm A$.氨水是弱碱,属于弱电解质,故用氨水和$\rm AlCl_{3}$溶液制备$\rm Al(OH)_{3}$的离子方程式为:$\text{A}\text{l}^{\text{3+}}+\text{3N}\text{H}_{\text{3}}\cdot\text{H}_{\text{2}}\text{O=Al}\left(\text{OH}\right)_{\text{3}}\downarrow\text{+3NH}_{\text{4}}^{+}$,$\rm A$错误;
$\rm B$.工业上用足量氨水吸收$\rm SO_{2}$生成${{\left( \text{N}{{\text{H}}_{\text{4}}}\right)}_{\text{2}}}\text{S}{{\text{O}}_{\text{3}}}$,故反应的化学方程式为:$\text{2N}{{\text{H}}_{\text{3}}}\cdot{{\text{H}}_{\text{2}}}\text{O}+\text{S}{{\text{O}}_{\text{2}}}={{\left(\text{N}{{\text{H}}_{\text{4}}} \right)}_{\text{2}}}\text{S}{{\text{O}}_{\text{3}}}+{{\text{H}}_{\text{2}}}\text{O}\rm, B$错误;
$\rm C$.由题干信息可知,用$\rm CuSO_{4}$溶液吸收$\rm PH_{3}$,生成$\rm H_{3}PO_{4}$、$\rm H_{2}SO_{4}$和$\rm Cu$,根据氧化还原反应配平可得该反应的化学方程式为:$\text{P}\text{H}_{\text{3}}+\text{4CuS}\text{O}_{\text{4}}+\text{4}\text{H}_{\text{2}}\text{O=4Cu}\downarrow+\text{H}_{\text{3}}\text{P}\text{O}_{\text{4}}+\text{4}\text{H}_{\text{2}}\text{S}\text{O}_{\text{4}}$,$\rm C$正确;
$\rm D$.由题干信息可知,次磷酸$\rm({{\text{H}}_{\text{3}}}\text{P}{{\text{O}}_{\text{2}}}\rm )$为一元弱酸,则次磷酸与足量$\rm NaOH$溶液反应:$\text{H}_{\text{3}}\text{P}\text{O}_{\text{2}}+\text{NaOH=Na}\text{H}_{\text{2}}\text{P}\text{O}_{\text{2}}+\text{H}_{\text{2}}\text{O}$,$\rm D$错误;
故选:$\rm C$
下列有关物质结构、性质和用途描述正确的是$(\quad\ \ \ \ )$
氨与水分子之间形成氢键,可用作制冷剂
","浓磷酸的黏度很大,主要原因是磷酸中共价键的键能较大
","磷酸难挥发,可用于保护金属免受腐蚀
","黑磷晶体中有两种作用力,该晶体是混合型晶体
"]$\rm A$.液氨作制冷剂,是液氨气化时吸收大量的热,使温度降低,与氨与水分子之间形成氢键无关,$\rm A$错误;
$\rm B$.浓磷酸的黏度很大,主要是磷酸分子间的作用力大,与分子内的共价键无关,原因是因为磷酸分子间形成氢键,$\rm B$错误;
$\rm C$.磷酸可与铁反应,在金属表面生成致密且难溶于水的磷酸盐膜,所以可用于保护金属免受腐蚀,与其难挥发性无关,$\rm C$错误;
$\rm D$.黑磷具有与石墨类似的层状结构,黑磷分子中每一层原子之间均由共价键结合,层与层之间均由范德华力结合,所以为混合型晶体,$\rm D$正确;
故选:$\rm D$
高中 | 核素题目答案及解析(完整版)
