高中 | 分子的极性 题目答案及解析
稿件来源:高途
高中 | 分子的极性题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第三节 分子的性质
分子的极性
由$\rm 10$个或$\rm 14$个碳原子组成的芳香性环形纯碳分子材料的合成方法如图所示。下列说法错误的是$(\qquad)$
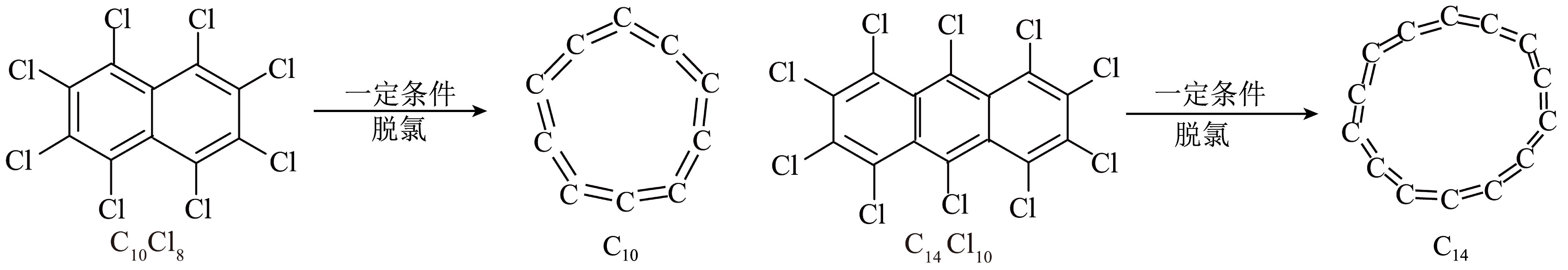
环形${{\\text{C}}_{10}}$的熔点低于金刚石
","${{\\text{C}}_{10}}\\text{C}{{\\text{l}}_{8}}$分子属于极性分子
","${{\\text{C}}_{14}}\\text{C}{{\\text{l}}_{10}}$分子中含有的$\\sigma $键类型为$\\text{p}-\\text{s}{{\\text{p}}^{2}}\\sigma $键和$\\text{s}{{\\text{p}}^{2}}-\\text{s}{{\\text{p}}^{2}}\\sigma $键
","基态$\\text{Cl}$原子核外电子的空间运动状态有$\\rm 9$种
"]$\rm A$.环形${{\text{C}}_{10}}$为分子晶体,而金刚石为共价晶体,环形${{\text{C}}_{10}}$的熔点低于金刚石,$\rm A$正确;
$\rm B$.${{\text{C}}_{10}}\text{C}{{\text{l}}_{8}}$含有蒽环,所有原子共平面,且分子中正负电荷中心重合,为非极性分子,$\rm B$错误;
$\rm C$.${{\text{C}}_{14}}\text{C}{{\text{l}}_{10}}$分子中$\text{Cl}-\text{C}\sigma $键类型为$\text{p}-\text{s}{{\text{p}}^{2}}\sigma $键,$\text{C}-\text{C}\sigma $键类型为$\text{s}{{\text{p}}^{2}}-\text{s}{{\text{p}}^{2}}\sigma $键,$\rm C$正确;
$\rm D$.基态$\text{Cl}$原子核外电子排布式为$\text{l}{{\text{s}}^{2}}2{{\text{s}}^{2}}2{{\text{p}}^{6}}3{{\text{s}}^{2}}3{{\text{p}}^{5}}$,空间运动状态有$\rm 9$种,$\rm D$正确。
故选:$\rm B$
高中 | 分子的极性题目答案及解析(完整版)
