高中 | 杂化轨道理论 题目答案及解析
稿件来源:高途
高中 | 杂化轨道理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
杂化轨道理论
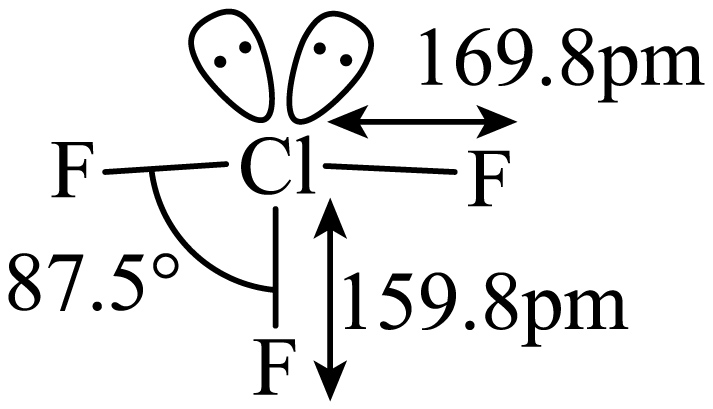
三氟化氯$\rm (Cl{{F}_{3}})$是极强助燃剂,能发生自耦电离:$\rm 2Cl{{F}_{3}}\rightleftharpoons ClF_{4}^{-}+Cl{F}_{2}^{+}$,其分子的空间构型如图,下列推测合理的是$\rm (\qquad)$
["
$\\rm Cl{{F}_{3}}$分子的中心原子杂化轨道类型为$\\rm {sp}^2$
","$\\rm Cl{{F}_{3}}$与$\\rm Fe$反应生成$\\rm FeC{{l}_{2}}$和$\\rm Fe{{F}_{2}}$
","$\\rm Cl{{F}_{3}}$分子是含有极性键的非极性分子
","$\\rm Br{{F}_{3}}$比$\\rm Cl{{F}_{3}}$更易发生自耦电离
"][["D"]]
$\rm A$.三氟化氯中氯原子的价层电子对数为$\rm 5$,杂化方式不可能为$\rm sp^{2}$杂化,故$\rm A$错误。
$\rm B$.由三氟化氯是极强助燃剂可知,三氟化氯与铁反应生成氯化铁和氟化铁,故$\rm B$错误。
$\rm C$.由图可知,三氟化氯是结构不对称的三角锥形分子,属于含有极性键的极性分子,故$\rm C$错误。
$\rm D$.溴元素的电负性小于氯元素,溴氟键的极性强于氯氟键,则三氟化溴比三氟化氯更易发生自耦电离,故$\rm D$正确。
故选:$\rm D$
高中 | 杂化轨道理论题目答案及解析(完整版)
去刷题
相关题库:
英菲替尼化合物是治疗胆管癌的新型药物,其合成路线如下。
化合物是一种常见的食品添加剂,被广泛应用于酱油等调味品中,的结构如图所示。其中、、、、为原子序数依次增大的短周期主族元素,的原子最外层电子数是电子层数的倍。下列说法正确的是
前周期主族元素、、、的原子序数依次增大。基态原子最外层电子数是内层电子数的倍,基态原子轨道半充满,分子为直线形。与处于同一主族。下列说法正确的是
科学家利用四种原子序数依次递增的短周期元素、、、“组合”成一种超分子,具有高效的催化性能,其分子结构示意图如下,实线代表共价键,其他重复单元的、未标注。、、分别位于不同周期,是同周期中金属性最强的元素。下列说法不正确的是
从微观视角探析物质结构及性质是学习化学的有效方法。下列说法正确的是
麦角酰乙二胺,常简称为“”,结构如图所示。下列有关说法错误的是
今日推荐 ![]()
![]()
![]()
