高中 | 杂化轨道理论 题目答案及解析
稿件来源:高途
高中 | 杂化轨道理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
杂化轨道理论
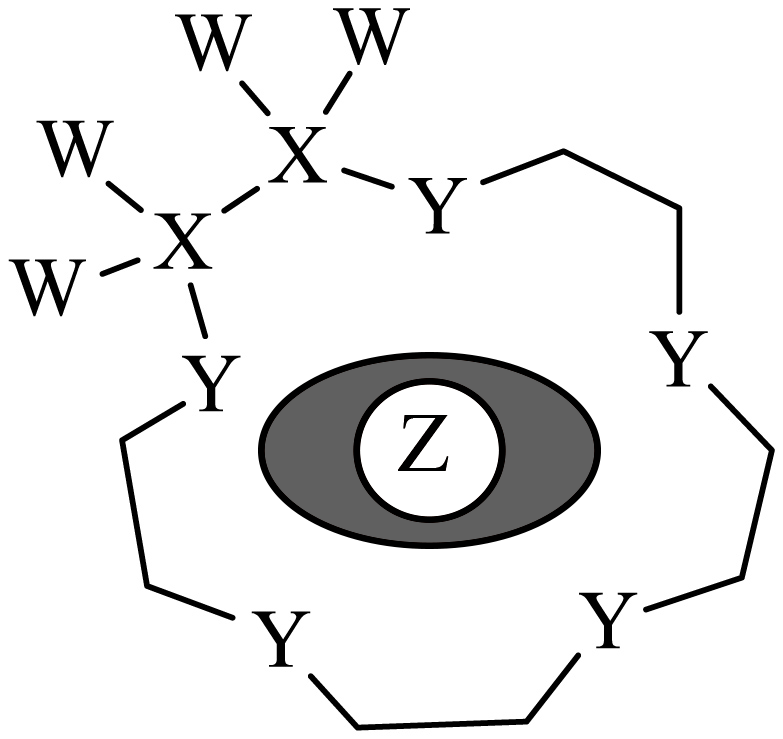
科学家利用四种原子序数依次递增的短周期元素$\rm W$、$\rm X$、$\rm Y$、$\rm Z$“组合”成一种超分子,具有高效的催化性能,其分子结构示意图如下,实线代表共价键,其他重复单元的$\rm W$、$\rm X$未标注。$\rm W$、$\rm X$、$\rm Z$分别位于不同周期,$\rm Z$是同周期中金属性最强的元素。下列说法不正确的是$(\qquad)$
基态原子半径:$\\rm X\\gt Y$
","$\\text{X}{{\\text{W}}_{\\text{4}}}$分子因形成分子间氢键,沸点高于同主族其他元素同类型化合物
","在该超分子中,$\\rm X$和$\\rm Y$的杂化方式相同,均为$\\text{s}{{\\text{p}}^{\\text{3}}}$
","改变同类别分子的“空穴”大小,可以识别某些金属阳离子
"]根据题意,$\rm W$、$\rm X$、$\rm Y$、$\rm Z$四种短周期元素的原子序数依次递增, $\rm W$、$\rm X$、$\rm Z$分别位于不同周期,可判断$\rm W$、$\rm X$、$\rm Z$分别位第一、二、三周期。根据图示可知$\rm W$形成$\rm 1$个共价键,说明$\rm W$是$\rm H$元素,$\rm Z$是同周期中金属性最强的元素,第三周期中金属性最强的元素是$\rm Na$元素。$\rm X$形成四个共价键,在第二周期符合条件的是$\rm C$元素,$\rm Y$形成$\rm 2$个共价键,原子序数比$\rm C$大,比$\rm Na$小,说明$\rm Y$原子核外有$\rm 2$个电子层,最外层有$\rm 6$个电子,则$\rm Y$是$\rm O$元素。
$\rm A$.碳原子和氧原子电子层数相同,但氧原子核电荷数大,因此原子半径氧原子小于碳原子,$\rm A$正确;
$\rm B$.$\rm XW_{4}$为$\rm CH_{4}$, $\rm CH_{4}$分子间不具备形成氢键的条件,不会形成分子间氢键,$\rm B$错误;
$\rm C$.在该超分子中,$\rm C$和$\rm O$的杂化方式相同,均为$\rm sp^{3}$,$\rm C$正确;
$\rm D$.改变同类别分子的“空穴”大小,就可以与半径不同的金属阳离子形成配合物,因此也可以识别某些金属阳离子,$\rm D$正确。
故选:$\rm B$
高中 | 杂化轨道理论题目答案及解析(完整版)
