高中 | 杂化轨道理论 题目答案及解析
稿件来源:高途
高中 | 杂化轨道理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
杂化轨道理论
某离子化合物的结构如图所示,其中$\rm X$、$\rm Y$、$\rm Z$、$\rm W$、$\rm Q$是原子序数依次增大的短周期主族元素,$\rm Z$与$\rm W$同主族。下列说法正确的是$\rm (\qquad)$
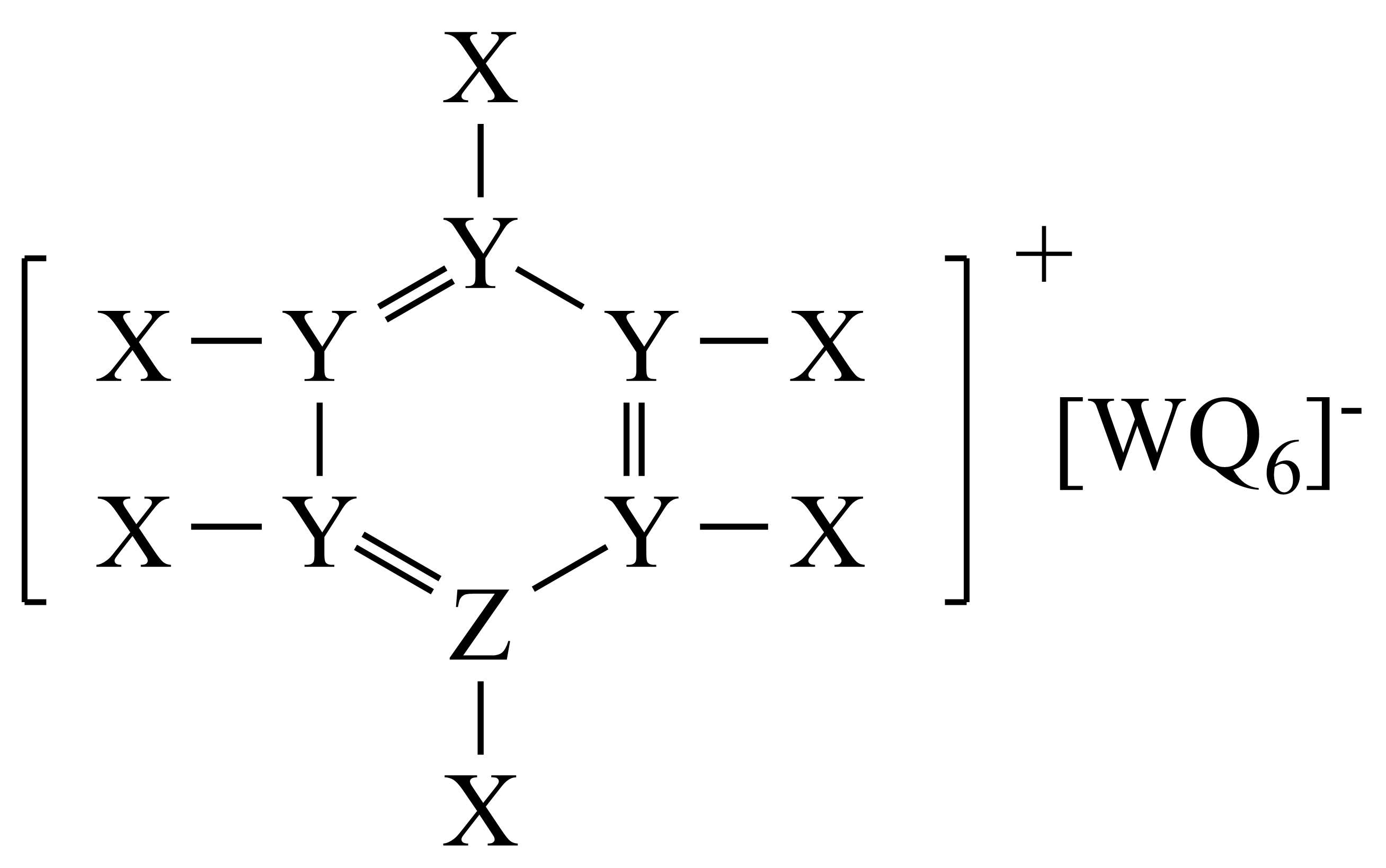
第一电离能:$\\rm Z\\lt W\\lt Q\\lt X$
","$\\rm [WQ_{6}]$⁻中$\\rm W$为$\\rm s{{p}^{3}}$杂化
","分子键角:$\\rm W{{X}_{3}}\\lt Z{{X}_{3}}$,与$\\rm W$、$\\rm Z$的电负性有关
","$\\rm W$的最高价氧化物对应的水化物有强氧化性
"]根据$\rm X$、$\rm Y$、$\rm Z$、$\rm W$、$\rm Q$是原子序数依次增大的短周期主族元素,$\rm Z$与$\rm W$同主族,$\rm Z$失去一个电子后形成四个键,最外层有$\rm 5$个电子,$\rm W$得到一个电子后形成$\rm 6$个键,$\rm W$最外层是$\rm 5$个电子,则$\rm Z$为$\rm N$元素,$\rm W$为$\rm P$元素,$\rm Q$的化合价为$\rm -1$价,$\rm Q$为$\rm Cl$元素,$\rm Y$形成四个键,$\rm Y$为$\rm C$元素,$\rm X$形成一个键为$\rm {H}$元素,由此分析此题;
$\rm A$.同族中随周期数增大,原子半径增大,第一电离能一般是上层元素 $\rm \gt $ 下层元素,故$\rm (A)$所给的“$\rm Z$ $\rm \lt $ $\rm W$”第一电离能上不符合规律,$\rm A$错误;
$\rm B$.$\rm {{[PC{{l}_{6}}]}^{-}}$中中心原子的成键电子对数为$\rm 6$,孤电子对数$\rm =\dfrac{5+1-1}{2}=0$,价层电子对数为$\rm 6$,不可能为$\rm s{{p}^{3}}$,故$\rm B$错误;
$\rm C$.$\rm W{{X}_{3}}(P{{H}_{3}})$和$\rm Z{{X}_{3}}(N{{H}_{3}})$中中心原子电负性$\rm P\rm \lt N$,故$\rm N$与$\rm {H}$形成的成键电子对电子云更容易靠近原子核,斥力大,键角大,故$\rm W{{X}_{3}}(P{{H}_{3}})\lt Z{{X}_{3}}(N{{H}_{3}})$,则与$\rm W$、$\rm Z$的电负性有关,故$\rm C$正确;
$\rm D$.$\rm W$($\rm P$)的最高价氧化物对应的水化物为磷酸,没有强氧化性,故$\rm D$错误;
故选:$\rm C$
高中 | 杂化轨道理论题目答案及解析(完整版)
