| 金属矿物的开发及利用 题目答案及解析
稿件来源:高途
| 金属矿物的开发及利用题目答案及解析如下,仅供参考!
必修二
第四章 化学与可持续发展
第一节 开发利用金属矿物和海水资源
金属矿物的开发及利用
某种电化学的电解液的组成如图所示,$\rm X$、$\rm Y$、$\rm Z$、$\rm Q$、$\rm W$为原子序数依次增大的短周期元素,$\rm Z$中含有$\rm 3$个单电子,下列说法正确的是$(\qquad)$
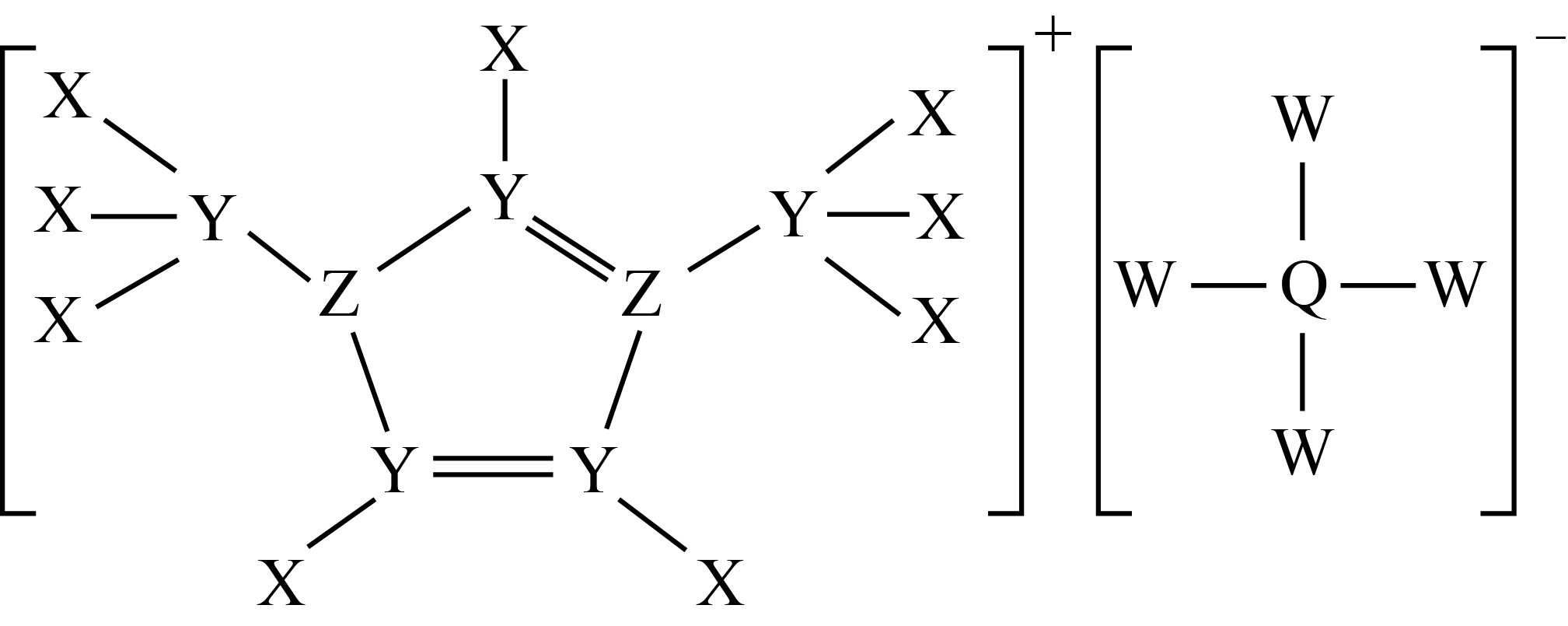
电解熔融$\\text{Q}{{\\text{W}}_{\\text{3}}}$可获得$\\rm Q$的单质
","原子半径:$\\rm Z\\gt Y$
","$\\rm W$的含氧酸均为强酸
","$\\text{QW}_{\\text{4}}^{-}$的空间构型为正四面体形
"]根据组成结构以及成键特点,$\rm X$和$\rm W$只有一个共价键,可能是为$\rm H$和卤族元素,$\rm Y$有四个共价键,五种元素原子序数依次增大,且属于短周期元素,因此$\rm Y$为$\rm C$,$\rm X$为$\rm H$,$\rm W$应为$\rm Cl$,一个$\rm Z$有三个共价键,因此该物质为离子化合物,形成四个键的$\rm Z$失去一个电子,且$\rm Z$中含有$\rm 3$个单电子,因此$\rm Z$为$\rm N$,$\rm Q$形成四个共价键中有一个配位键,因此$\rm Q$为$\rm Al$,据此分析;
根据上述分析,$\rm X$为$\rm H$,$\rm Y$为$\rm C$,$\rm Z$为$\rm N$,$\rm Q$为$\rm Al$,$\rm W$为$\rm Cl$,
$\rm A$.$\rm QW_{3}$为$\rm AlCl_{3}$,氯化铝为分子晶体,熔融状态不导电,因此工业上上常电解氧化铝获得金属铝,故$\rm A$错误;
$\rm B$.同周期从左向右原子半径依次减小$\rm ($稀有气体除外$\rm )$,因此$\rm C$的原子半径大于$\rm N$,故$\rm B$错误;
$\rm C$.氯的含氧酸可能为强酸,如$\rm HClO_{4}$,也可能为弱酸,如$\rm HClO$,故$\rm C$错误;
$\rm D$.$\rm AlCl_{\text{4}}^{-}$中$\rm Al$有$\rm 4$个$\rm \sigma$键,无孤电子对数,即该离子空间构型为正四面体,故$\rm D$正确。
故选:$\rm D$
| 金属矿物的开发及利用题目答案及解析(完整版)
