高中 | 氯气 题目答案及解析
稿件来源:高途
高中 | 氯气题目答案及解析如下,仅供参考!
必修一
第四章 非金属及其化合物
第二节 富集在海水中的元素——氯
氯气
实验室用如下装置制取氯气,并进行性质实验。回答下列问题;
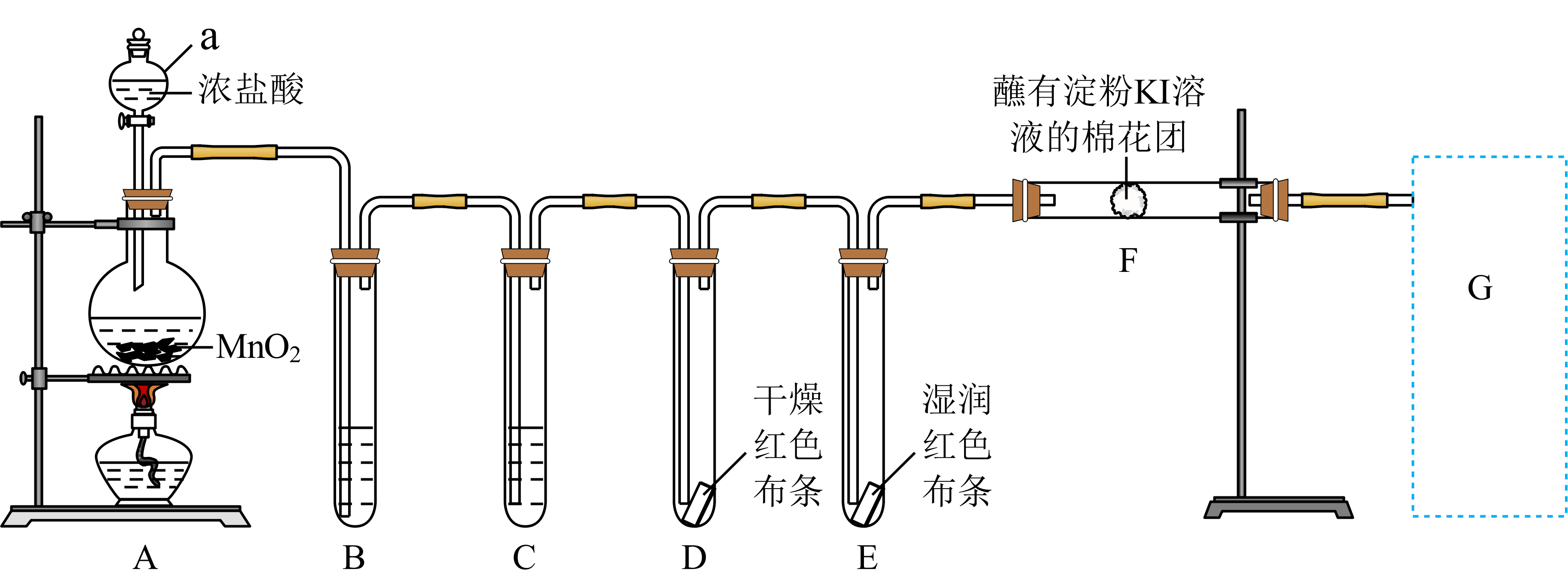
写出$\rm A$中反应的化学方程式 。
$\\rm MnO_{2}+4HCl(浓 ) \\begin{matrix} \\underline{\\underline{\\triangle}} \\\\ {} \\\\ \\end{matrix}\\rm MnCl_{2}+Cl_{2}↑+2H_{2}O$
"]]$\rm A$中的浓盐酸与二氧化锰在加热条件下反应生成氯气,反应的化学方程式为$\rm MnO_{2}+4HCl(浓 ) \begin{matrix} \underline{\underline{\triangle}} \\ {} \\ \end{matrix}\rm MnCl_{2}+Cl_{2}↑+2H_{2}O$;
能证明氯气无漂白性的现象是 。
$\\rm D$中红色布条无明显变化,$\\rm E$中布条褪色
"]]干燥的氯气没有漂白性,氯气和水反应生成的次氯酸有漂白性,氯气能使湿润的有色布条褪色,不能使干燥的有色布条褪色,即可说明氯气无漂白性;
$\rm F$处观察到棉花团变蓝色,说明氯气具有 性$\rm ($填“氧化”或“还原”$\rm )$。
氧化
"]]通入$\rm Cl_{2}$时发生反应$\rm 2I^{-}+Cl_{2}= 2Cl^{-}+I_{2}$,生成的$\rm I_{2}$遇淀粉溶液变蓝色,体现了氯气的氧化性;
写出$\rm G$处尾气吸收的离子方程式 。
$\\text{C}{{\\text{l}}_{\\text{2}}}\\text{+2O}{{\\text{H}}^{-}}\\text{=C}{{\\text{l}}^{-}}\\text{+Cl}{{\\text{O}}^{-}}+{{\\text{H}}_{\\text{2}}}\\text{O}$
"]]$\rm G$中用氢氧化钠溶液吸收尾气,反应的离子方程式为$\text{C}{{\text{l}}_{\text{2}}}\text{+2O}{{\text{H}}^{-}}\text{=C}{{\text{l}}^{-}}\text{+Cl}{{\text{O}}^{-}}+{{\text{H}}_{\text{2}}}\text{O}$;
实验室还可用$\text{KMn}{{\text{O}}_{\text{4}}}$固体与浓盐酸常温下反应制备氯气;
$\left( \,\,\,\,\, \right)\text{KMn}{{\text{O}}_{4}}+\left( \,\,\,\,\, \right)\text{HCl}\left(浓 \right)=\left( \,\,\,\,\, \right)\text{KCl}+\left( \,\,\,\,\, \right)\text{MnC}{{\text{l}}_{2}}+\left( \,\,\,\,\, \right)\text{C}{{\text{l}}_{2}}\uparrow +\left( \,\,\,\,\,\,\, \right){{\text{H}}_{2}}\text{O}\rm ($未配平$\rm )$。
请写出该反应配平后的离子方程式: 。若生成等量的$\text{C}{{\text{l}}_{2}}$,所需$\text{Mn}{{\text{O}}_{\text{2}}}$与$\text{KMn}{{\text{O}}_{\text{4}}}$的物质的量之比为 。
$2\\text{KMn}{{\\text{O}}_{4}}+16\\text{HCl}\\left( 浓\\right)=2\\text{KCl}+2\\text{MnC}{{\\text{l}}_{2}}+5\\text{C}{{\\text{l}}_{2}}\\uparrow +8{{\\text{H}}_{2}}\\text{O}$;$\\rm 2: 5$
"]]反应中$\text{KMn}{{\text{O}}_{\text{4}}}\rm →MnCl_{2}$中,$\rm Mn$元素由$\rm +7$价变为$\rm +2$价,降$\rm 5$,$\rm 2HCl→Cl_{2}$中,$\rm Cl$元素化合价由$\rm -1$价升为$\rm 0$升$\rm 1\times \rm 2$,最小公倍数为$\rm 10$,结合质量守恒配平得反应$2\text{KMn}{{\text{O}}_{4}}+16\text{HCl}\left(浓 \right)=2\text{KCl}+2\text{MnC}{{\text{l}}_{2}}+5\text{C}{{\text{l}}_{2}}\uparrow +8{{\text{H}}_{2}}\text{O}$;根据反应$2\text{KMn}{{\text{O}}_{4}}+16\text{HCl}\left(浓 \right)=2\text{KCl}+2\text{MnC}{{\text{l}}_{2}}+5\text{C}{{\text{l}}_{2}}\uparrow +8{{\text{H}}_{2}}\text{O}$,$\rm MnO_{2}+4HCl(浓 ) \begin{matrix} \underline{\underline{\triangle}} \\ {} \\ \end{matrix}\rm MnCl_{2}+Cl_{2}↑+2H_{2}O$,若生成等量的$\text{C}{{\text{l}}_{2}}$,所需$\text{Mn}{{\text{O}}_{\text{2}}}$与$\text{KMn}{{\text{O}}_{\text{4}}}$的物质的量之比为$\rm 2: 5$。
高中 | 氯气题目答案及解析(完整版)
