高中 | 氯气 题目答案及解析
稿件来源:高途
高中 | 氯气题目答案及解析如下,仅供参考!
必修一
第四章 非金属及其化合物
第二节 富集在海水中的元素——氯
氯气
某同学用$\text{KMn}{{\text{O}}_{4}}$与浓盐酸反应制备纯净的$\text{C}{{\text{l}}_{2}}$的装置如图所示。回答下列问题:
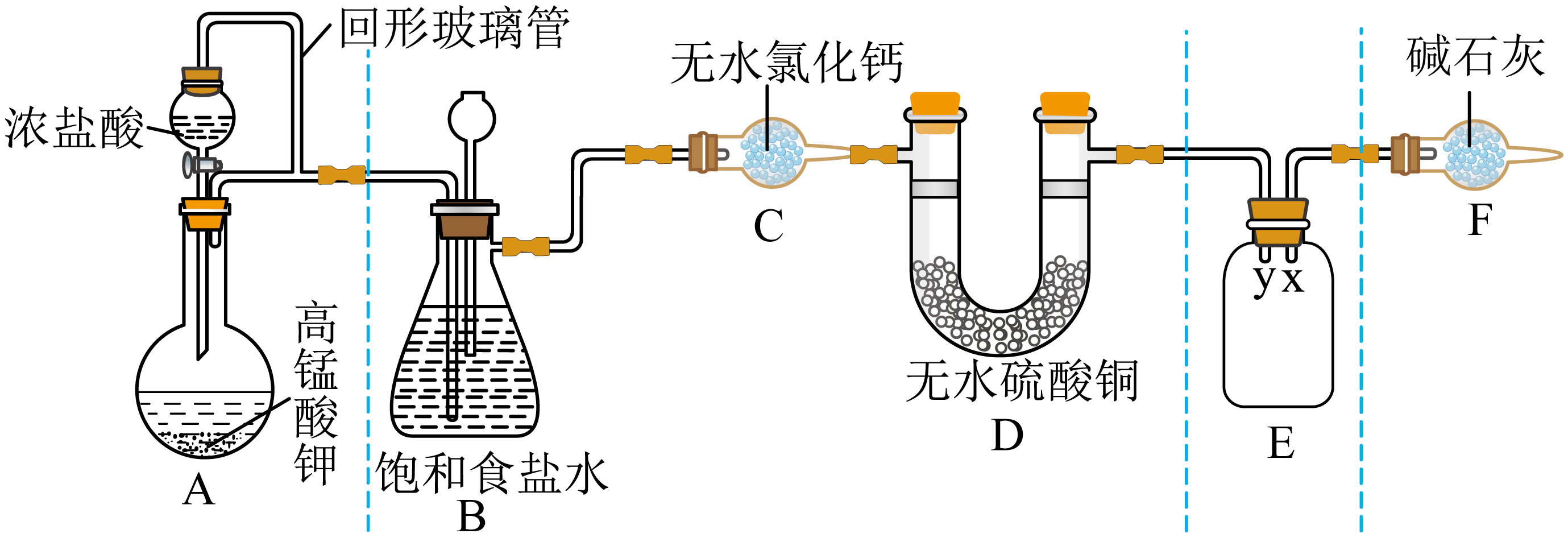
装置$\rm A$中盛放浓盐酸的仪器名称是 ,$\rm A$中反应的化学方程式为 。
分液漏斗;$\\rm 2KMnO_{4}+16HCl(浓 )=2KCl+5Cl_{2}↑+2MnCl_{2}+8H_{2}O$
"]]根据仪器的外形可知,装置$\rm A$中盛放浓盐酸的仪器名称为分液漏斗;$\rm KMnO_{4}$与浓盐酸反应生成$\rm KCl$、$\rm Cl_{2}$、$\rm MnCl_{2}$和$\rm H_{2}O$,反应的方程式为$\rm 2KMnO_{4}+16HCl(浓 )=2KCl+5Cl_{2}↑+2MnCl_{2}+8H_{2}O$;
$\rm E$装置中导管$\rm ($填“$\rm x$”或“$\rm y$”$\rm )$ 应伸至靠近集气瓶底部。
$\\rm y$
"]]氯气的密度大于空气,应该用向上排空气法收集,气体长进短出,$\rm y$应伸至靠近集气瓶底部;
装置$\text{F}$的作用有两个:一 ,二是 。请写出氯气与碱石灰中$\text{NaOH}$反应的化学方程式 。
吸收多余的氯气,防止污染空气;防止空气中的水蒸气进入$\\rm E$装置;$\\rm Cl_{2}+2NaOH=NaCl+NaClO+H_{2}O$
"]]根据分析,$\rm F$中碱石灰的作用为一是吸收多余的氯气,防止污染空气,二是防止空气中的水蒸气进入$\rm E$装置;碱石灰中含有$\rm NaOH$,氯气与$\rm NaOH$反应生成$\rm NaCl$、$\rm NaClO$和水,化学方程式为$\rm Cl_{2}+2NaOH=NaCl+NaClO+H_{2}O$;
$\text{C}{{\text{l}}_{2}}$、$\text{HClO}$和$\text{Cl}{{\text{O}}^{-}}$三种微粒的物质的量分数随$\text{pH}\rm ($即$ {c}({{\text{H}}^{+}})\rm )$变化的关系如图所示。
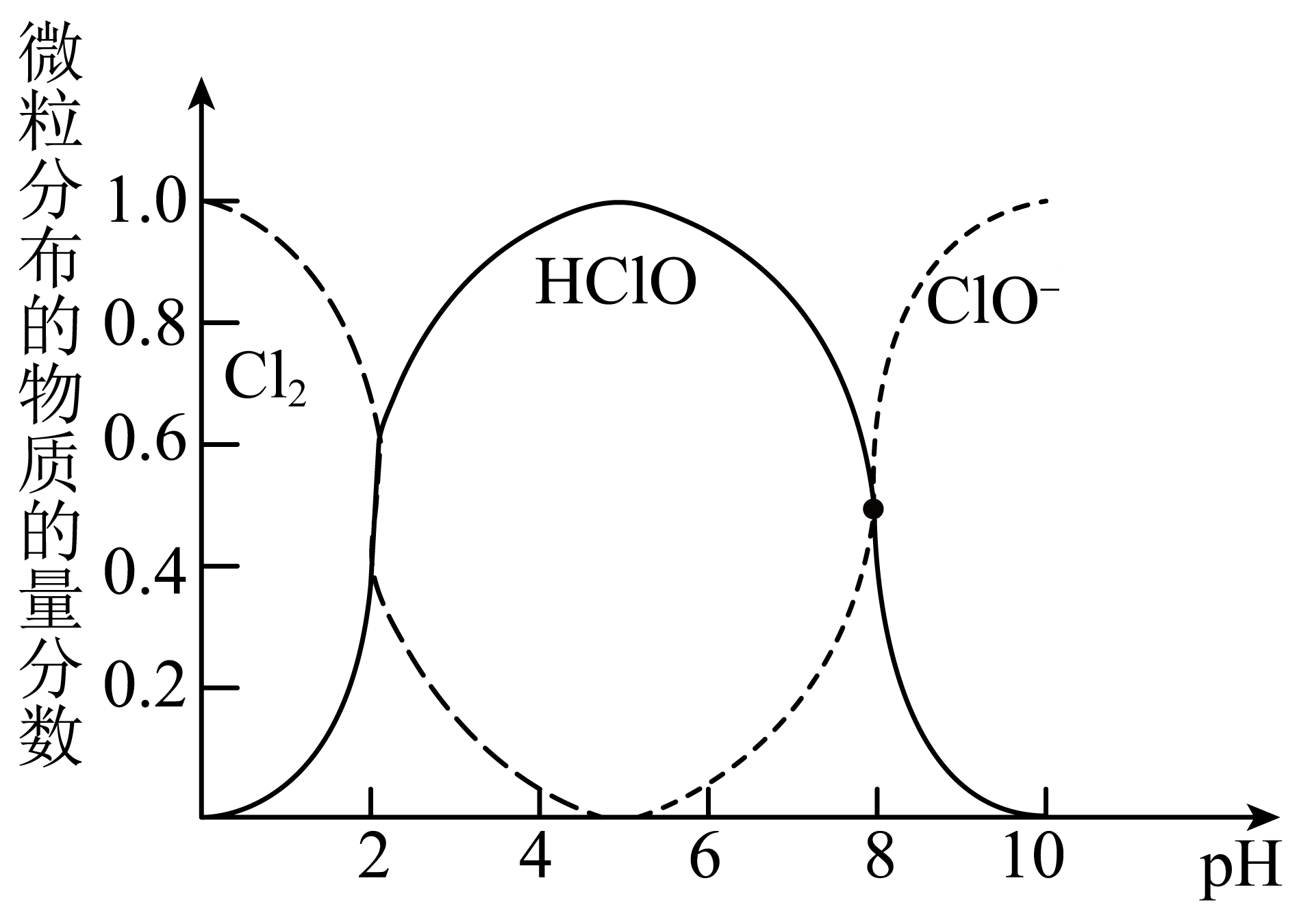
①使用$\rm 84$消毒液时为增强消毒效果常调节$4\lt \text{pH}\lt 6$,原因是 。
②通常购买的$\rm 84$消毒液$\text{pH}$在$\rm 12$左右,为增强消毒效果可向其中滴加 。
$\rm A$.可口可乐 $\rm B$.稀$\rm {{\text{H}}_{2}}\text{S}{{\text{O}}_{4}}$ $\rm C$.食醋 $\rm D$.浓盐酸
$\\rm 4\\lt pH\\lt 6$时,溶液中$\\rm HClO$含量较高,消毒能力强;$\\rm ABC$
"]]①$\rm 84$消毒液中有效成分为$\rm HClO$,从图中可知,$\rm pH$在$\rm 4-6$之间时,$\rm HClO$的物质的量分数最大,消毒能力最强,因此使用$\rm 84$消毒液时将$\rm pH$调节至$\rm 4-6$;
②$\rm A$.可口可乐中含有碳酸,碳酸酸性强于次氯酸,能降低$\rm 84$消毒液的$\rm pH$值,生成次氯酸,增强消毒效果,$\rm A$正确;
$\rm B$.稀硫酸酸性强于次氯酸,可降低$\rm 84$消毒液的$\rm pH$值,生成$\rm HClO$增强消毒作用,$\rm B$正确;
$\rm C$.食醋中的醋酸酸性强于次氯酸,能降低$\rm 84$消毒液$\rm pH$值生成$\rm HClO$,增强消毒效果,$\rm C$正确;
$\rm D$.浓盐酸能与$\rm 84$消毒液中的次氯酸根离子反应生成氯气,产生有毒气体并降低了消毒效果,$\rm D$错误;
实验室将$\text{C}{{\text{l}}_{2}}$通入质量分数$\rm 40\%$的$\text{NaOH}$溶液中来制备$\rm 84$消毒液。当$\text{NaOH}$消耗一半时转移电子数为${{N}_{\text{A}}}$,计算此时所得溶液中$\text{NaClO}$的质量分数为 $\rm \%$。$\rm ($保留一位小数$\rm )$
$\\rm 15.8\\%$
"]]$\rm 2NaOH+Cl_{2}=NaCl+NaClO+H_{2}O$,该反应中$\rm 1\;\rm mol\;\rm Cl_{2}$参与反应转移$\rm 1\;\rm mol$电子,现转移电子数为$N\rm _{A}$,说明参与反应的$\rm NaOH$有$\rm 2\;\rm mol$,此时$\rm NaOH$消耗一半,则$\rm NaOH$共有$\rm 4\;\rm mol$,质量为$\rm 160\;\rm g$,则原溶液总质量为$\dfrac{160\text{ g}}{40\%}\rm =400\;\rm g$,生成$\rm NaClO$的物质的量为$\rm 1\;\rm mol$,质量为$\rm 74.5\;\rm g$,此时溶液的总质量为$\rm 400\;\rm g+71\;\rm g=471\;\rm g$,则次氯酸钠的质量分数为$\dfrac{74.5\text{ g}}{471\text{ g}}\rm \times 100\%≈15.8\%$。
高中 | 氯气题目答案及解析(完整版)
