高中 | 离子化合物 题目答案及解析
稿件来源:高途
高中 | 离子化合物题目答案及解析如下,仅供参考!
必修二
第一章 物质结构 元素周期律
第三节 化学键
离子化合物
现代社会中,人类的一切活动都离不开能量,研究化学能与热能、电能的转化具有重要价值。回答下列问题:
为了减少交通事故危害,安全措施也极为重要,汽车的安全气囊内有叠氮化钠$\rm (NaN_{3})$与硝酸铵$\rm (NH_{4}NO_{3})$等物质。当汽车高速行驶中受到猛烈撞击时,这些物质会迅速发生分解反应,产生大量气体,充满气囊,从而保护驾驶员和乘客的安全。
下列判断正确的是$(\quad\ \ \ \ )\rm ($填序号$\rm )$。
道路起雾与$\\rm H_{2}O$分子中的化学键断裂有关
","$\\rm NH_{4}NO_{3}$中只含有极性共价键
","$\\rm NaN_{3}$受到猛烈撞击时有化学键的断裂
","$\\rm NaN_{3}$、$\\rm NH_{4}NO_{3}$均属于离子化合物
"]$\rm A$.道路起雾属于物理变化,与化学键没有关系,选项$\rm A$错误;
$\rm B$. $\rm NH_{4}NO_{3}$中$\rm N$和$\rm H$、$\rm N$和$\rm O$之间只含有极性共价键,但铵根和硝酸根之间还有离子键,选项$\rm B$错误;
$\rm C$.$\rm NaN_{3}$受到猛烈撞击时迅速发生分解反应,产生大量气体,充满气囊,所以化学变化,化学键一定断裂,选项$\rm C$正确;
$\rm D$.$\rm NaN_{3}$、$\rm NH_{4}NO_{3}$均属于离子化合物,选项$\rm D$正确;
汽车的安全气囊内叠氮化钠爆炸过程中的能量变化如图所示:
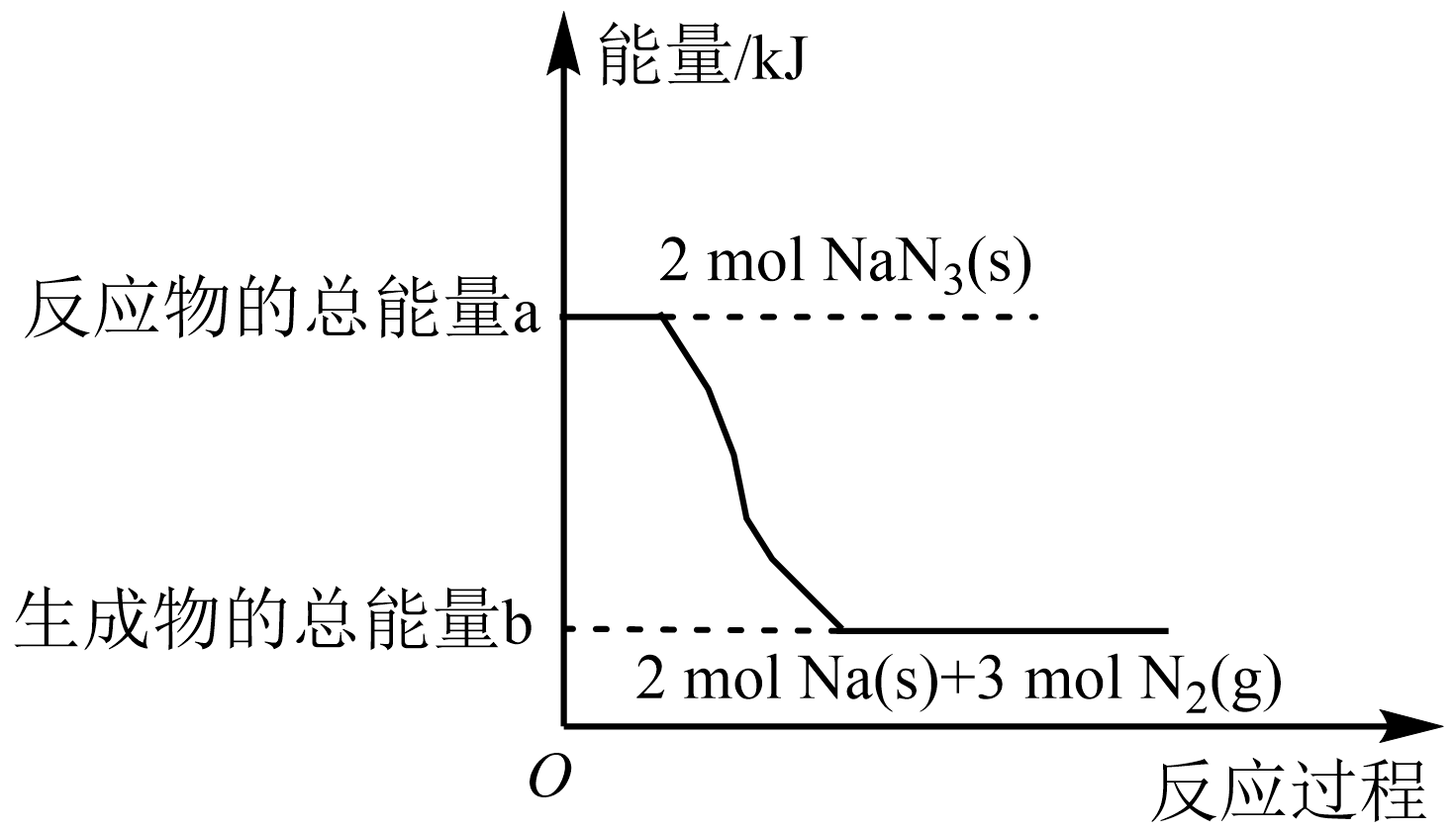
①叠氮化钠的爆炸反应属于 $\rm ($填“吸热”或“放热”$\rm )$反应。
②若上述爆炸过程中的能量变化为$2(a-b)\;\rm kJ$,则消耗叠氮化钠的质量为 $\rm g$。
③若安全气囊的体积为$ V\;\rm L$,$\rm NaN_{3}$的爆炸在$ t\;\rm s$内完成,反应过程中消耗$\rm 292.5\;\rm g\;\rm NaN_{3}$,则用$\rm N_{2}$表示的反应速率为 $\rm mol·L^{-1}·s^{-1.}$
放热;$\\rm 260$;$\\dfrac{{6}{.75}}{{Vt}}$
"]]①反应反应物总能量高于生成物总能量,叠氮化钠的爆炸反应属放热反应;
②叠氮化钠分解的化学方程式为$\rm 2NaN_{3}=2Na+3N_{2}↑$,由图可知,每消耗$\rm 2\;\rm mol\;\rm NaN_{3}$,释放能量$ (a-b)\;\rm kJ$,若上述爆炸过程中的能量变化为$ 2(a-b)\;\rm kJ$,则消耗$\rm 4\;\rm mol\;\rm NaN_{3}$,其质量为$4\;\rm {mol}\times {65\;\rm g/mol=260\;\rm g}$;
③若安全气囊的体积为$ V\;\rm L$,$\rm NaN_{3}$的爆炸在$ t\;\rm s$内完成,反应过程中消耗$\rm 292.5\;\rm g\;\rm NaN_{3}$、其物质的量为$\dfrac{{292}{.5\;\rm g}}{{65\;\rm g/mol}}=4.5\;\rm {mol}$,生成氮气$\rm 6.75\;\rm mol$,则用$\rm N_{2}$表示的反应速率为$\dfrac{{6}{.75\;\rm mol}}{{V\;\rm L}\times {t\;\rm s}} = \dfrac{{6}{.75}}{{Vt}}\;\rm \rm mol/(L·s)$。
电能是现代社会应用最广泛的能源之一,化学电源应用于现代社会的生产和生活。
①下列反应可设计成原电池的是 $\rm ($填序号$\rm )$。
$\rm A$.$\rm CaO+H_{2}O=Ca(OH)_{2}$ $\rm B$.$\rm 2H_{2}+O_{2}=2H_{2}O$
$\rm C$.$\rm 2FeCl_{3}+Cu=CuCl_{2}+2FeCl_{2}$ $\rm D$.$\rm KOH+HCl=KCl+H_{2}O$
②某实验小组为了探究化学能与热能的转化,设计了如图所示的三套实验装置$\rm A$、$\rm B$和$\rm C$:
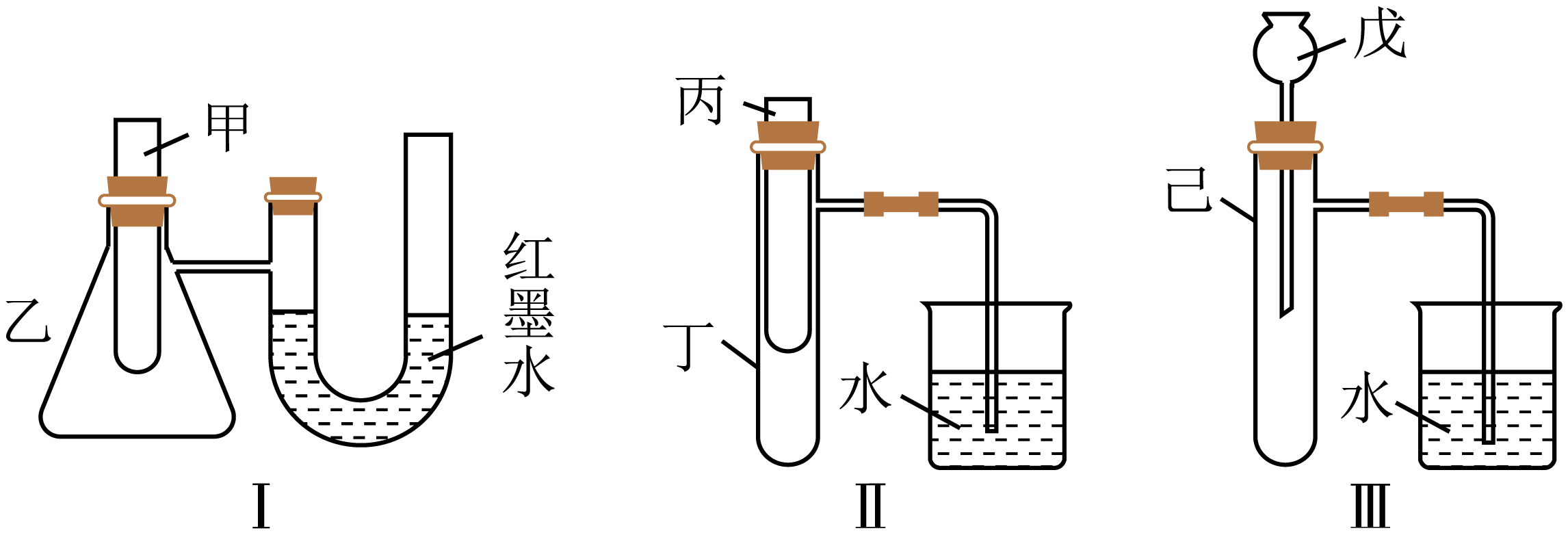
能探究“肼与过氧化氢的反应是吸热反应还是放热反应”的装置是 $\rm ($从上图中选择“$\rm A$”、“$\rm B$”或“$\rm C$”$\rm )$。
③实验室设计肼氧燃料电池装置如下图所示,$\rm a$、$\rm b$均为不参与反应的电极。电池工作时,空气从 $\rm ($填“$\rm A$”或“$\rm B$”$\rm )$口通入。
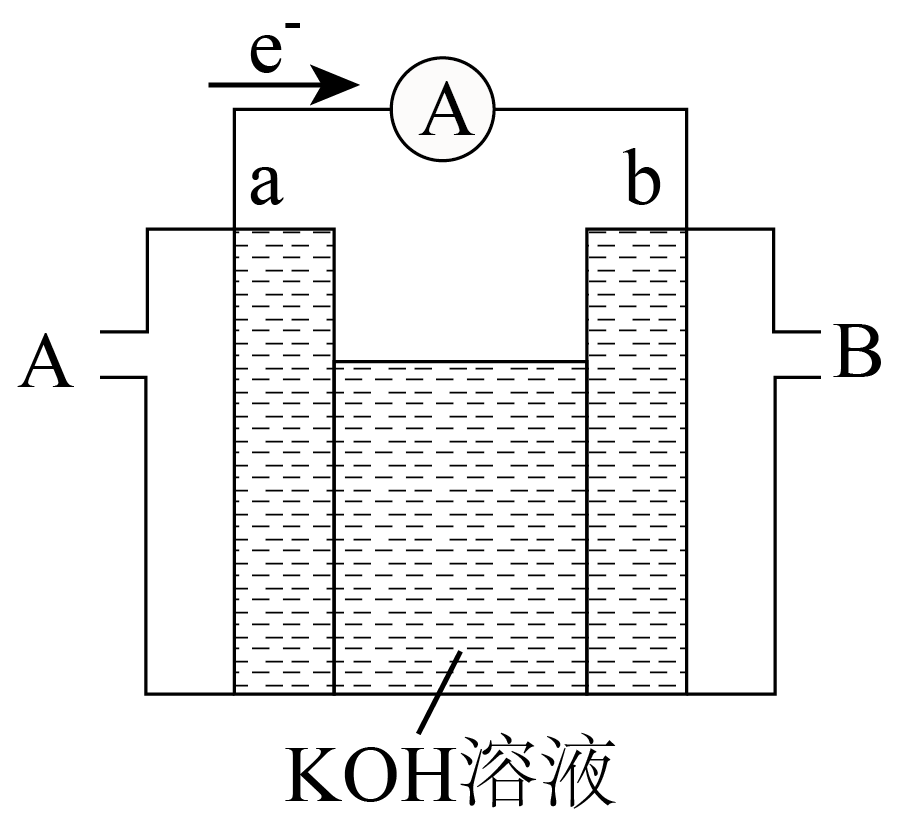
④若肼氧燃料电池产物为氮气和水,试写出负极的电极反应式 。
$\\rm BC$;$\\rm AB$;$\\rm B$;$\\rm {{\\text{N}}_{\\text{2}}}{{\\text{H}}_{\\text{4}}} -4 {{\\text{e}}^{-}}\\text{+4O}{{\\text{H}}^{-}}={{\\text{N}}_{\\text{2}}}\\uparrow \\text{+4}{{\\text{H}}_{\\text{2}}}\\text{O}$
"]]①$\rm A$.$\rm CaO+H_{2}O=Ca(OH)_{2}$是非氧化还原反应,不能设计成原电池,则不可实现化学能直接转化为电能,$\rm A$不符合题意;
$\rm B$.$\rm 2H_{2}+O_{2}=2H_{2}O$是放热的氧化还原反应,能设计为原电池,可实现化学能直接转化为电能,$\rm B$符合题意;
$\rm C$.$\rm 2FeCl_{3}+Cu=CuCl_{2}+2FeCl_{2}$是氧化还原反应,能设计为原电池,可实现化学能直接转化为电能,$\rm C$符合题意;
$\rm D$.$\rm KOH+HCl=KCl+H_{2}O$是非氧化还原反应,不能设计成原电池,则不可实现化学能直接转化为电能,$\rm D$不符合题意;
故选:$\rm BC$;
②装置$\rm A$可通过$\rm U$形管中红墨水液面的变化判断 “肼与过氧化氢的反应是吸热反应还是放热反应”,若反应放热,则红墨水液面左低右高,若反应吸热,则红墨水液面左高右低;
装置$\rm B$可通过烧杯中是否产生气泡判断“肼与过氧化氢的反应是吸热反应还是放热反应”,若反应放热,导管口又气泡茶水,若反应吸热,则导管内有一段水柱;
装置$\rm C$不能判断“肼与过氧化氢的反应是吸热反应还是放热反应”,因为通过长颈漏斗,具支试管内气体与大气相通,不管反应是否放热或吸热,不会产生压强差,烧杯内没有明显现象;
故选:$\rm AB$;
③由图可知,电子从电极$\rm a$流出,则电极$\rm a$为负极,电极$\rm b$为正极,电池工作时,氧气在正极得到电子被还原,故空气从$\rm B$口通入。
④若肼氧燃料电池产物为氮气和水,则肼在负极失去电子被氧化生成氮气,则负极的电极反应式:$\rm {{\text{N}}_{\text{2}}}{{\text{H}}_{\text{4}}}-4 {{\text{e}}^{-}}\text{+4O}{{\text{H}}^{-}}={{\text{N}}_{\text{2}}}\uparrow \text{+4}{{\text{H}}_{\text{2}}}\text{O}$。
高中 | 离子化合物题目答案及解析(完整版)
