高中 | 杂化轨道理论 题目答案及解析
稿件来源:高途
高中 | 杂化轨道理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
杂化轨道理论
硒$\rm (Se)$是一种有重要作用的元素,可以形成多种化合物。
基态硒原子的核外电子排布式为 。
$\\rm [Ar]3d^{10}4s^{2}4p^{4}$
"]]硒为$\rm 34$号元素,基态$\rm Se$原子核外电子排布式为$\rm [Ar]3d^{10}4s^{2}4p^{4}$。
$\rm H_{2}SeO_{3}$的中心原子杂化类型是 ,$\rm SeO_{\text{3}}^{\text{2}-}$的空间结构是 。
$\\rm sp^{3}$;三角锥形
"]]$\rm H_{2}SeO_{3}$的中心原子的价层电子对数为$\rm {3+}\dfrac{{1}}{{2}}\times [{ 6-2-2}\times {(2-1) }]{ }\rm =4$,所以$\rm Se$杂化方式为$\rm sp^{3}$杂化,$\rm {SeO}_{{3}}^{{2-}}$的中心原子$\rm Se$的价层电子对数为$\rm {3+}\dfrac{{1}}{{2}}\times [{ 6-2-2}\times {(2-1) }]{ }\rm =4$,有一对孤电子对,所以$\rm {SeO}_{{3}}^{{2-}}$的立体构型是三角锥形。
$\rm H_{2}Se$属于 $\rm ($填“极性”或“非极性”$\rm )$分子。
极性
"]]$\rm H_{2}Se$分子中有孤电子对,立体构型为$\rm V$形,正、负电荷中心不重合,所以$\rm H_{2}Se$属于极性分子;
${{\text{H}}_{\text{2}}}\text{Se}$的沸点 $\rm ($填“高于”或“低于”$\rm ){{\text{H}}_{\text{2}}}\text{O}$,其原因是 。
低于;两者都是分子晶体,由于水存在分子间氢键,沸点高
"]]$\rm H_{2}Se$比$\rm H_{2}O$沸点低;因为$\rm H_{2}O$中存在分子间氢键,沸点较高, $\rm H_{2}Se$不存在氢键;
硒化锌是一种重要的半导体材料,其晶胞结构如图所示,该硒化锌的化学式为 ;该晶胞中硒原子的配位数为 ;若该晶胞密度为$\rm \rho\;\rm g·cm^{-3}$,$N\rm _{A}$代表阿伏加德罗常数的值,则晶胞参数$a$为 $\rm pm$。
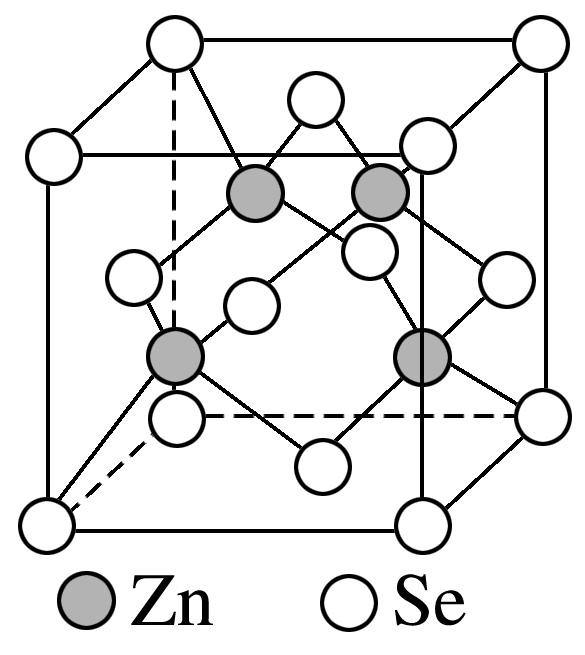
$\\rm ZnSe$;$\\rm 4$;$\\sqrt[3]{\\dfrac{576}{{{N}_{\\text{A}}}\\cdot \\rho }}\\times {{10}^{10}}$
"]]根据硒化锌晶胞结构图可知,每个锌原子周围有$\rm 4$个硒原子,每个硒原子周围也有$\rm 4$个锌原子,所以硒原子的配位数为$\rm 4$;该晶胞中含有硒原子数为$\rm 8\times \dfrac{1}{8}\rm +6\times \dfrac{1}{2}\rm =4$,含有锌原子数为$\rm 4$,化学式为$\rm ZnSe$;根据$ \rho=\dfrac{m}{V} =\dfrac{\dfrac{{4}\times {144}}{{{{N}}_{\rm {A}}}}}{{V}}=\dfrac{\dfrac{{576}}{{{{N}}_{\rm {A}}}}}{{V}}$,所以$ V=\dfrac{576}{\dfrac \rho{{N}_{\rm {A}}} }$,则晶胞参数$a$为$\sqrt[{3}]{\dfrac{{576}}{{{N}_{\rm {A}}}\cdot \rho}}{\;\rm cm}=\sqrt[{3}]{\dfrac{{576}}{{{N}_{\rm {A}}}\cdot\rho}}\rm \times 10^{10}\;\rm pm$。
高中 | 杂化轨道理论题目答案及解析(完整版)
