高中 | 杂化轨道理论 题目答案及解析
稿件来源:高途
高中 | 杂化轨道理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
杂化轨道理论
铁及其化合物在生活中有广泛应用。
$\text{F}{{\text{e}}^{2+}}$可被${{\text{H}}_{2}}{{\text{O}}_{2}}$或${{\text{O}}_{3}}$氧化为$\text{F}{{\text{e}}^{3+}}$。
①$\text{F}{{\text{e}}^{3+}}$基态核外电子排布式为 。
②${{\text{H}}_{2}}{{\text{O}}_{2}}$属于 分子$\rm ($填“极性”或“非极性”$\rm )$,${{\text{O}}_{3}}$分子中$\rm O$原子间的化学键属于 键$\rm ($填“极性”或“非极性”$\rm )$。
$\\rm 1{{\\text{s}}^{2}}2{{\\text{s}}^{2}}2{{\\text{p}}^{6}}3{{\\text{s}}^{2}}3{{\\text{p}}^{6}}3{{\\text{d}}^{5}}$或$\\rm \\left[ \\text{Ar} \\right]3{{\\text{d}}^{5}}$;极性;极性
"]]①$\rm \text{F}{{\text{e}}^{3+}}$基态核外电子排布式:$\rm 1{{\text{s}}^{2}}2{{\text{s}}^{2}}2{{\text{p}}^{6}}3{{\text{s}}^{2}}3{{\text{p}}^{6}}3{{\text{d}}^{5}}$或$\rm \left[ \text{Ar} \right]3{{\text{d}}^{5}}$;
②$\rm {{\text{H}}_{2}}{{\text{O}}_{2}}$分子结构为$\rm H-O-O-H$,虽然$\rm O-O$键属于非极性键,但两个$\rm O-H$键的偶极矩方向不同,无法完全抵消,导致$\rm {{\text{H}}_{2}}{{\text{O}}_{2}}$分子体现出极性,为极性分子;在$\rm {{\text{O}}_{3}}$分子的中心$\rm O$原子通过$\rm s{{p}^{2}}$杂化形成两个$\rm \sigma$键,导致$\rm {{\text{O}}_{3}}$分子呈$\rm V$形结构,形成的共价键类型为:极性键。
实验室用$\rm KSCN$溶液、苯酚检验$\text{F}{{\text{e}}^{3+}}$。
①$\rm 1\;\rm mol$苯酚分子中含有$\rm \sigma$键的数目为 。
②类卤素离子$\rm SCN$可用于$\text{F}{{\text{e}}^{3+}}$的检验,其对应的酸有两种,分别为硫氰酸$\left( \text{H}-\text{S}-\text{C}\equiv \text{N} \right)$和异硫氰酸$\left( \text{H}-\text{N}=\text{C}=\text{S} \right)$,这两种酸中沸点较高的是 ,原因是 。
③$\rm C$、$\rm N$、$\rm O$的第一电离能的由大到小的顺序为 。
$\\rm 13\\;\\rm mol$或$\\rm 7.826\\times {{10}^{24}}$;异硫氰酸或$\\rm \\text{H}-\\text{N}=\\text{C}=\\text{S}$;异硫氰酸能形成分子间氢键;$\\rm \\text{N}\\gt \\text{O}\\gt \\text{C}$
"]]①苯酚的结构为:$\rm {{\text{C}}_{6}}{{\text{H}}_{5}}-OH$,$\rm 1$个苯酚分子中含$\rm \sigma$键的数目为:$\rm 6$个$\rm \text{C}-\text{C}$键、$\rm 5$个$\rm \text{C}-\text{H}$、$\rm 1$个$\rm \text{C}-\text{O}$、$\rm 1$ 个$\rm \text{O}-\text{H}$键,共有$\rm 13$个$\rm \sigma$键,则$\rm 1\;\rm mol$苯酚分子中含有$\rm \sigma$键的数目为:$\rm 13\;\rm mol$或$\rm 7.826\times {{10}^{24}}$个;
②根据硫氰酸$\rm \left( \text{H}-\text{S}-\text{C}\equiv \text{N} \right)$和异硫氰酸$\rm \left( \text{H}-\text{N}=\text{C}=\text{S} \right)$的结构可知,由于$\rm N$的电负性比$\rm S$强,使$\rm \text{H}-\text{N}=\text{C}=\text{S}$能形成分子间的氢键作用,所以沸点:$\rm \text{H}-\text{N}=\text{C}=\text{S}\gt \text{H}-\text{S}-\text{C}\equiv \text{N}$;
③同周期主族元素第一电离能从左向右呈逐渐增大趋势,但$\rm N$原子的$\rm 2p$能级处于半充满结构,失去$\rm 1$个电子反而比右侧的$\rm O$原子难,导致第一电离比$\rm O$大,所以$\rm C$、$\rm N$、$\rm O$的第一电离能的由大到小的顺序为:$\rm \text{N}\gt \text{O}\gt \text{C}$。
某铁的化合物结构简式如图所示。
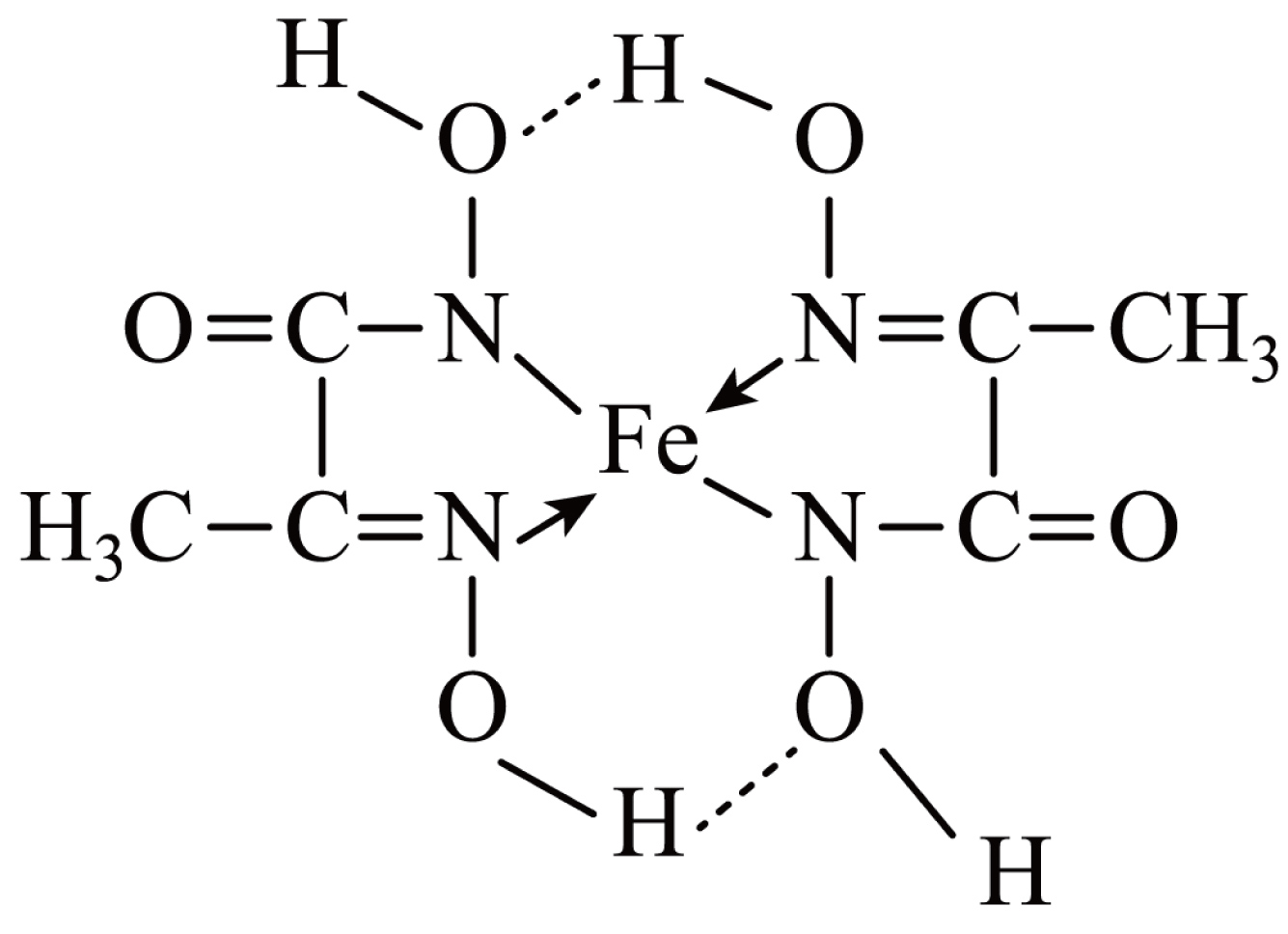
①上述化合物中所含有的非金属元素的电负性由大到小的顺序为 $\rm ($用元素符号表示$\rm )$。
②上述化合物中氮原子的杂化方式为 。
③上述化合物中存在的相互作用有 。
$\rm a$、离子键 $\rm b$、共价键 $\rm c$、配位键 $\rm d$、氢键 $\rm e$、金属键
$\\text{O}\\gt \\text{N}\\gt \\text{C}\\gt \\text{H}$;$\\text{s}{{\\text{p}}^{3}}$和$\\mathrm{sp}^2$;$\\rm bcd$
"]]①化合物 中所含有的非金属元素分别为:$\rm H$、$\rm C$、$\rm N$、$\rm O$;非金属性越强,电负性越大,可以得到这些元素的电负性由大到小的顺序为:$\rm \text{O}\gt \text{N}\gt \text{C}\gt \text{H}$;②上述化合物中氮原子有$\rm 2$种结合方式:$\rm 1.$形成$\rm 3$个$\rm \sigma$键的$\rm N$原子还剩$\rm 1$个孤电子对,属于四面体结构,采用的是$\rm \text{s}{{\text{p}}^{3}}$杂化;$\rm 2.$形成$\rm 1$个$\rm \sigma$键、$\rm 1$个$\rm \sigma$配位键、$\rm 1$个$\rm \pi$键的$\rm N$原子无孤电子对,属于平面三角形结构,采用的是$\rm s{{p}^{\text{2}}}$杂化;
中所含有的非金属元素分别为:$\rm H$、$\rm C$、$\rm N$、$\rm O$;非金属性越强,电负性越大,可以得到这些元素的电负性由大到小的顺序为:$\rm \text{O}\gt \text{N}\gt \text{C}\gt \text{H}$;②上述化合物中氮原子有$\rm 2$种结合方式:$\rm 1.$形成$\rm 3$个$\rm \sigma$键的$\rm N$原子还剩$\rm 1$个孤电子对,属于四面体结构,采用的是$\rm \text{s}{{\text{p}}^{3}}$杂化;$\rm 2.$形成$\rm 1$个$\rm \sigma$键、$\rm 1$个$\rm \sigma$配位键、$\rm 1$个$\rm \pi$键的$\rm N$原子无孤电子对,属于平面三角形结构,采用的是$\rm s{{p}^{\text{2}}}$杂化;
③根据化合物 的结构,可以看出结构存在的相互作用有:共价键、$\rm \text{N}\to Fe$配位键、$\rm \text{H}\cdots \text{O}$氢键,所给的五个选项中,符合的选项为:$\rm bcd$。
的结构,可以看出结构存在的相互作用有:共价键、$\rm \text{N}\to Fe$配位键、$\rm \text{H}\cdots \text{O}$氢键,所给的五个选项中,符合的选项为:$\rm bcd$。
高中 | 杂化轨道理论题目答案及解析(完整版)
