| 杂化轨道理论 题目答案及解析
稿件来源:高途
| 杂化轨道理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
杂化轨道理论
${{\text{C}}_{60}}$独特的笼状结构使其及其衍生物表现出特殊的性质。
金刚石与${{\text{C}}_{60}}$的晶胞结构如图,比较二者熔点大小:金刚石 ${{\text{C}}_{60}}\rm ($填“$\gt $”、“$\lt $”或“$=$”$\rm )$,并从结构角度分析原因 。
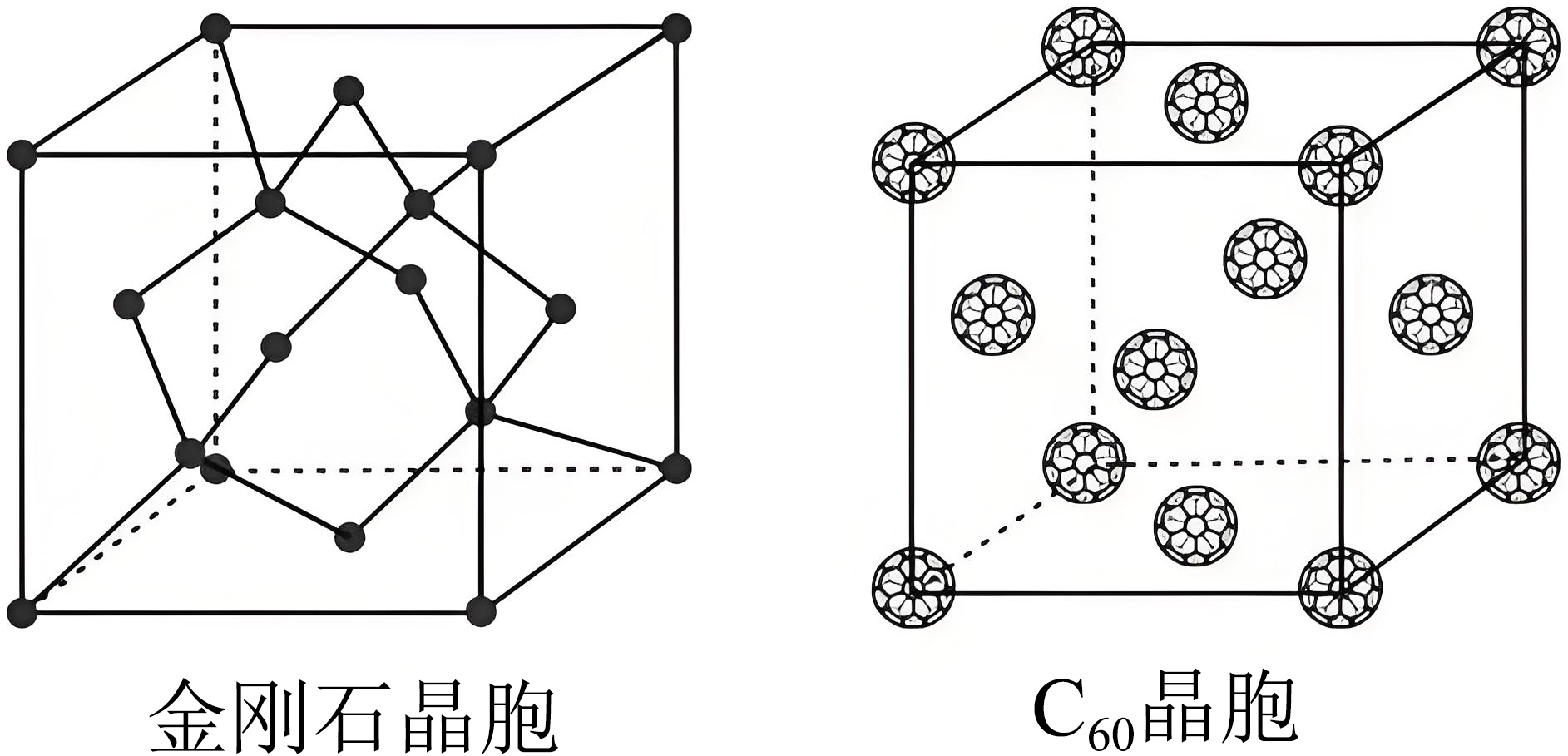
$\\gt $;金刚石是共价晶体,${{\\text{C}}_{60}}$晶体是分子晶体,二者熔化时分别破坏共价键和分子间作用力,共价键的强度大于分子间作用力,故金刚石熔点高于${{\\text{C}}_{60}}$
"]]金刚石的熔点大于${{\text{C}}_{60}}$,因为金刚石为共价晶体, ${{\text{C}}_{60}}$为分子晶体,二者熔化时分别破坏共价键和分子间作用力,共价键的强度大于分子间作用力,故金刚石熔点高于${{\text{C}}_{60}}$。
一种金属富勒烯配合物合成过程如图所示。已知:烯烃、${{\text{C}}_{60}}$等因能提供$\text{ }\!\!\pi$电子与中心原子形成配位键,被称为“$\text{ }\!\!\pi$配体”。
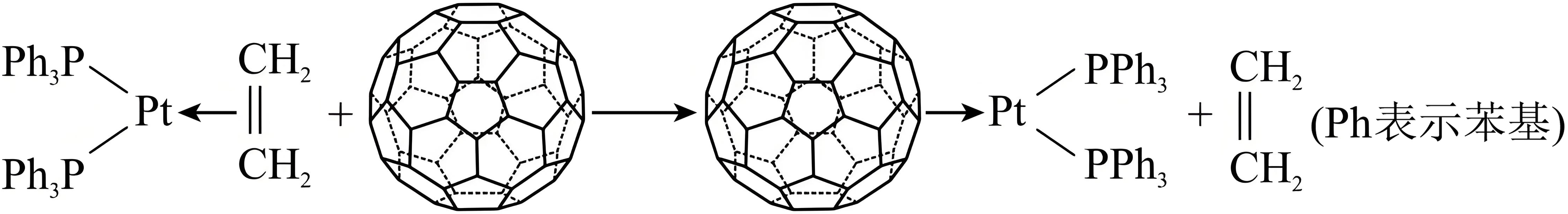
①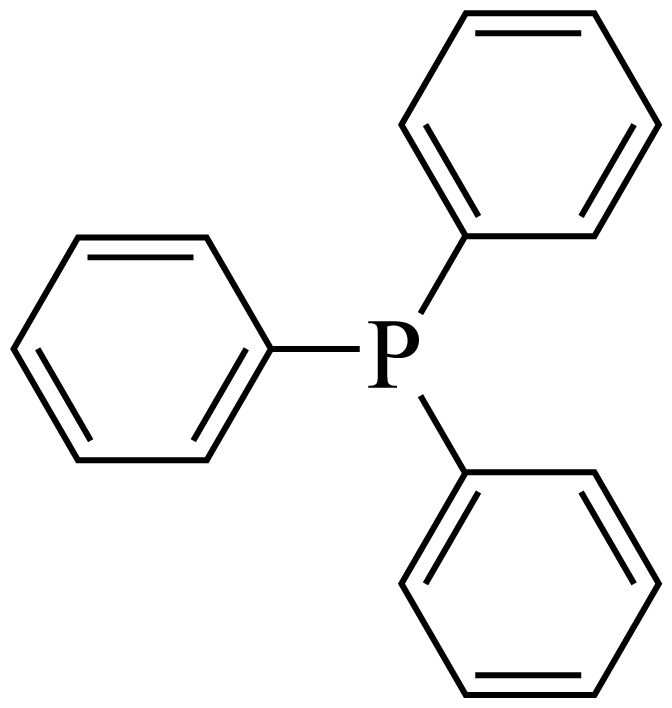 $\rm (\text{PP}{{\text{h}}_{3}}\rm )$内中心$\rm P$原子的杂化轨道类型是 。
$\rm (\text{PP}{{\text{h}}_{3}}\rm )$内中心$\rm P$原子的杂化轨道类型是 。
②比较两种$\pi$配体与$\rm Pt$的配位能力大小:${{\text{C}}_{2}}{{\text{H}}_{4}}$ ${{\text{C}}_{60}}\rm ($填“$\gt $”、“$\lt $”或“$=$”$\rm )$。
③结合${{\text{C}}_{60}}$中$\rm C$原子的成键特点,分析${{\text{C}}_{60}}$可作为$\pi$配体的原因 。
$\\text{s}{{\\text{p}}^{3}}$;$<$;$\\text{C}_{60}$中每个$\\rm C$原子形成$\\rm 3$个$\\sigma\\!\\!\\text{ }$键,未参与形成$\\sigma$键的电子形成大$\\text{ }\\!\\!\\pi$键,故能提供$\\pi\\!\\!\\text{ }$电子与中心原子形成配位键
"]]① 三苯基膦中,中心$\rm P$原子形成$\rm 3$个$\sigma\!\!\text{ }$键和$\rm 1$个孤电子对,为$\text{s}{{\text{p}}^{\text{3}}}$杂化;
②${{\text{C}}_{2}}{{\text{H}}_{4}}{{\text{C}}_{60}}$都是$\pi$配体,能够通过$\pi$电子与中心金属原子形成配位键,${{\text{C}}_{60}}$分子由$\rm 60$个碳原子组成,形成球状结构,每个碳原子通过$\text{s}{{\text{p}}^{\text{2}}}$杂化与相邻的三个碳原子形成$\sigma$键,未参与杂化的一个$\text{p}$轨道上的电子形成离域$\pi$键,具有更大的$\pi$电子云,因此其配位能力更强,则与$\rm Pt$的配位能力大小:${{\text{C}}_{2}}{{\text{H}}_{4}}\lt {{\text{C}}_{60}}$。
③${{\text{C}}_{60}}$分子由$\rm 60$个碳原子组成,形成球状结构,每个碳原子通过$\rm sp^{2}$杂化与相邻的三个碳原子形成$\sigma$键,未参与杂化的一个$\text{p}$轨道上的电子形成离域$\pi$键,这种离域$\pi$键能够提供$\pi$电子与中心原子形成配位键。
${{\text{C}}_{60}}$的碱金属$\rm (\text{M}=\text{K}$、$\rm Rb$、$\rm Cs)$衍生物的晶胞结构如图。
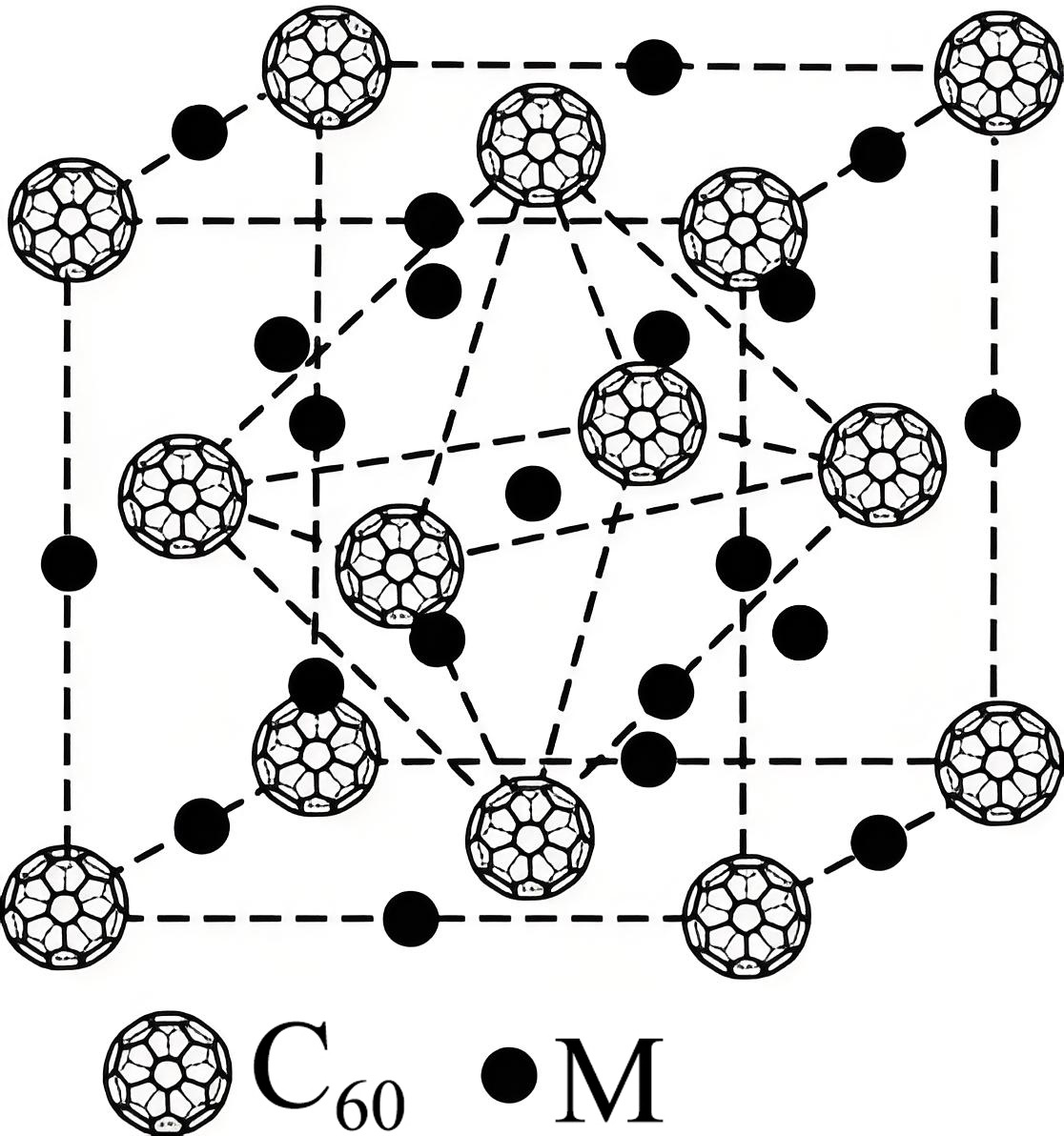
①与每个${{\text{C}}_{60}}$分子紧邻且等距的${{\text{C}}_{60}}$分子数目为 。
②某种${{\text{C}}_{60}}$的碱金属衍生物的化学式为${{\text{M}}_{3}}{{\text{C}}_{60}}$,每个晶胞中含有的$\rm M$原子的数目是 。
③当$\rm M$代表$\rm K$时,晶胞边长为$\rm \textit a\ nm$,阿伏加德罗常数为$\textit{N}_{\text{A}}$。该晶体密度为 $\text{g}\cdot \text{c}{{\text{m}}^{\text{-3}}}\rm (1\;\rm \text{nm}=1\times {{10}^{-7}}\;\rm \text{cm}\rm )$。
$\\rm 12$;$\\rm 12$;$\\dfrac{3348}{\\textit{N}_{\\text{A}}\\times\\textit{a}^{3}\\times10^{-21}}$
"]]① 由晶胞结构可知,$\rm C_{60}$分子位于晶胞的顶点和面心,则与每个$\rm C_{60}$分子紧邻且等距的$\rm C_{60}$分子数目为$\rm 12$;
②某种$\rm C_{60}$的碱金属衍生物的化学式为$\rm M_{3}C_{60}$,该晶胞中$\rm C_{60}$分子的个数为$8\times \dfrac{1}{8}+6\times \dfrac{1}{2}=4$,则每个晶胞中含有的$\rm M$原子的数目是$4\times 3=12$;
③当$\rm M$代表$\rm K$,晶胞边长为$\rm \textit a\ nm$,阿伏加德罗常数为$\rm \textit N_{A}$时,该晶体密度为:$\dfrac{4\text{M}}{\left( \textit{a}\times10^{-7}\right)^{3}\cdot\textit{N}_{\text{A}}}=\dfrac{3348}{\textit{N}_{\text{A}}\times\textit{a}^{3}\times10^{-21}}\ \text{g/c}\text{m}^{3}$。
| 杂化轨道理论题目答案及解析(完整版)
