| 杂化轨道理论 题目答案及解析
稿件来源:高途
| 杂化轨道理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
杂化轨道理论
钠离子电池和钾离子电池是具有应用前景的二次电池。某钠离子电池以$\rm NaClO_4$的碳酸丙烯酯溶液作电解质溶液,${\rm N}{{\rm a}_{x}}\rm [MnFe{{(CN)}_{6}}]$作正极材料。
$\rm C{{O}_{2}}$与环氧丙烷在一定条件下反应制得碳酸丙烯酯。
①$\rm C{{O}_{2}}$是 $\rm ($填“极性”或“非极性”$\rm )$分子。
②环氧丙烷中,$\rm O$原子的杂化类型是 杂化。
③沸点:环氧丙烷 $\rm C{{O}_{2}}($填“$\rm \gt $”或“$\rm \lt $”$\rm )$,解释其原因: 。
非极性;$\\rm sp^{3}$;$\\rm \\gt $;环氧丙烷与$\\rm CO_{2}$都形成分子晶体,环氧丙烷的相对分子质量大于$\\rm CO_{2}$,分子间作用力环氧丙烷大于$\\rm CO_{2}$,则沸点高
"]]①$\rm CO_{2}$分子中,$\rm C$原子的价层电子对数为$\rm 2+\dfrac{4-4}{2}=2$,发生$\rm sp$杂化,分子呈直线形结构,是非极性分子。
②环氧丙烷分子中,$\rm O$原子与$\rm 2$个$\rm C$原子分别以单键相连,其价层电子对数为$\rm \dfrac{6+2\times 1}{2}=4$,杂化轨道类型是$\rm sp^{3}$杂化。
③环氧丙烷与$\rm CO_{2}$都形成分子晶体,环氧丙烷的相对分子质量大于$\rm CO_{2}$,分子间作用力环氧丙烷大于$\rm CO_{2}$,则沸点:环氧丙烷$\rm \gt CO_{2}$。
$\rm MnC{{l}_{2}}$溶液与$\rm N{{a}_{4}}[Fe{{(CN)}_{6}}]$溶液混合可制备${\rm N}{{\rm a}_{x}}[\rm MnFe{{(CN)}_{6}}]$晶体。
①基态$\rm Mn$原子的电子排布式是 。
②$\rm C{{N}^{-}}$的性质与卤素离子相近,被称为拟卤离子,$\rm {{(CN)}_{2}}$被称为拟卤素。
ⅰ$\rm .{{(CN)}_{2}}$与$\rm {{H}_{2}}O$反应的生成物的结构式分别是$\rm H-C \equiv N$、 。
ⅱ$\rm .HCN$有酸性但乙炔无明显酸性,$\rm HCN$的酸性比乙炔的强的原因是 。
$\\rm [Ar]3d^{5}4s^{2}$;$\\rm H-O-C\\equiv N$;$\\rm N$原子的电负性大,$\\rm -CN$具有吸电子效应,使$\\rm HCN$中$\\rm H-C$的极性更大,更易断裂
"]]①$\rm Mn$是第$\rm 25$号元素,基态$\rm Mn$原子的电子排布式是$\rm [Ar]3d^{5}4s^{2}$。
②$\rm i$.$\rm Cl_{2}$与$\rm H_{2}O$反应,生成$\rm HCl$和$\rm HClO$,采用类推法,可确定$\rm (CN)_{2}$与$\rm H_{2}O$反应的生成物为$\rm HCN$、$\rm HOCN$,则结构式分别是$\rm H-C\equiv N$、$\rm H-O-C\equiv N$。
ⅱ.$\rm HCN$有酸性但乙炔无明显酸性,乙炔为非极性分子而$\rm HCN$为极性分子,且$\rm H$、$\rm C$间的共用电子对偏离$\rm H$原子,则$\rm HCN$的酸性比乙炔的强,原因是:$\rm N$原子的电负性大,$\rm -CN$具有吸电子效应,使$\rm HCN$中$\rm H-C$的极性更大,更易断裂。
$\rm \overset{+3}{\mathop{Mn}}\,[\overset{+3}{\mathop{Fe}}\,{{(CN)}_{6}}]$可用作钾离子电池的正极材料,其晶胞结构如下图所示。
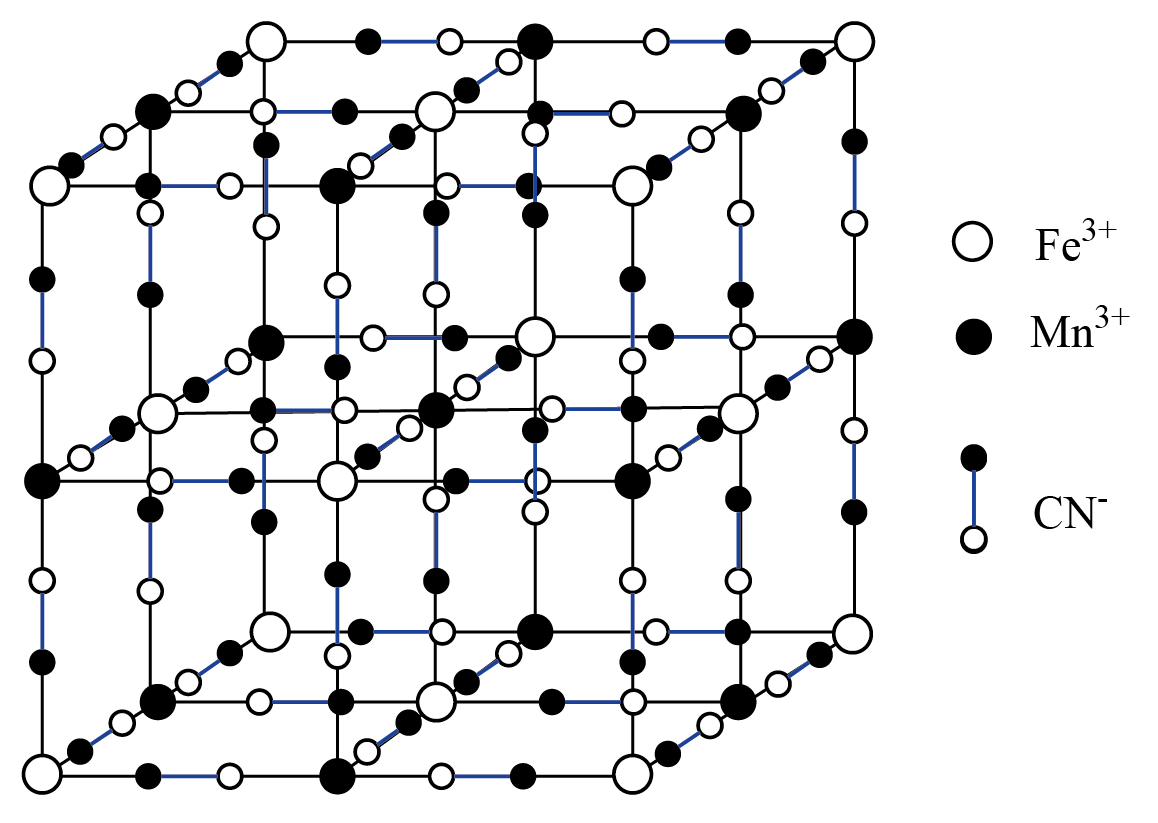
①距离$\rm M{{n}^{3+}}$最近的$\rm F{{e}^{3+}}$有 个。
②第三电离能${{I}_{3}}$:$\rm Mn\gt Fe$,结合原子结构解释原因: 。
③$\rm Mn[Fe{{(CN)}_{6}}]$放电后转化为$\rm {{K}_{2}}Mn[Fe{{(CN)}_{6}}]$,充电时物质的变化如下:
$\rm {{K}_{2}}\overset{+2}{\mathop{Mn}}\,[\overset{+2}{\mathop{Fe}}\,{{(CN)}_{6}}]\overset{充电}{\mathop{\to }}\,A\overset{充电}{\mathop{\to }}\,\overset{+3}{\mathop{Mn}}\,[\overset{+3}{\mathop{Fe}}\,{{(CN)}_{6}}]$
充电时生成$\rm A$的电极反应式: $\rm ($请标注$\rm A$中$\rm Fe$和$\rm Mn$的化合价$\rm )$。
$\\rm 6$;$\\rm M{{n}^{2+}}$的价电子为$\\rm 3{{d}^{5}}$较稳定结构,不易失去第三个电子,$\\rm F{{e}^{2+}}$的价电子为$\\rm 3d^6$易失去$\\rm 1$个电子形成$\\rm 3{{d}^{5}}$较稳定结构;$\\rm {{K}_{2}}Mn[Fe{{(CN)}_{6}}]-{{e}^{-}}=K\\overset{+2}{\\mathop{Mn}}\\,[\\overset{+3}{\\mathop{Fe}}\\,{{(CN)}_{6}}]+{{K}^{+}}$
"]]①根据如图信息,距离$\rm Mn^{3+}$最近的$\rm Fe^{3+}$有$\rm 6$个。
②$\rm M{{n}^{2+}}$的价电子为$\rm 3{{d}^{5}}$较稳定结构,不易失去第三个电子,$\rm F{{e}^{2+}}$的价电子为$\rm 3d^6$易失去$\rm 1$个电子形成$\rm 3{{d}^{5}}$较稳定结构,所以第三电离能$I_{3}$:$\rm Mn\gt Fe$。
③$\rm Mn[Fe{{(CN)}_{6}}]$放电后转化为$\rm {{K}_{2}}Mn[Fe{{(CN)}_{6}}]$,$\rm Mn[Fe{{(CN)}_{6}}]$中,$\rm Fe$和$\rm Mn$均为$\rm +3$价,则$\rm A$为$\rm KMn[Fe{{(CN)}_{6}}]$,充电时生成$\rm A$的电极反应为:$\rm {{K}_{2}}Mn[Fe{{(CN)}_{6}}]-{{e}^{-}}=K\overset{+2}{\mathop{Mn}}\,[\overset{+3}{\mathop{Fe}}\,{{(CN)}_{6}}]+{{K}^{+}}$。
| 杂化轨道理论题目答案及解析(完整版)
