高中 | 氯气的制法 题目答案及解析
稿件来源:高途
高中 | 氯气的制法题目答案及解析如下,仅供参考!
必修一
第四章 非金属及其化合物
第二节 富集在海水中的元素——氯
氯气的制法
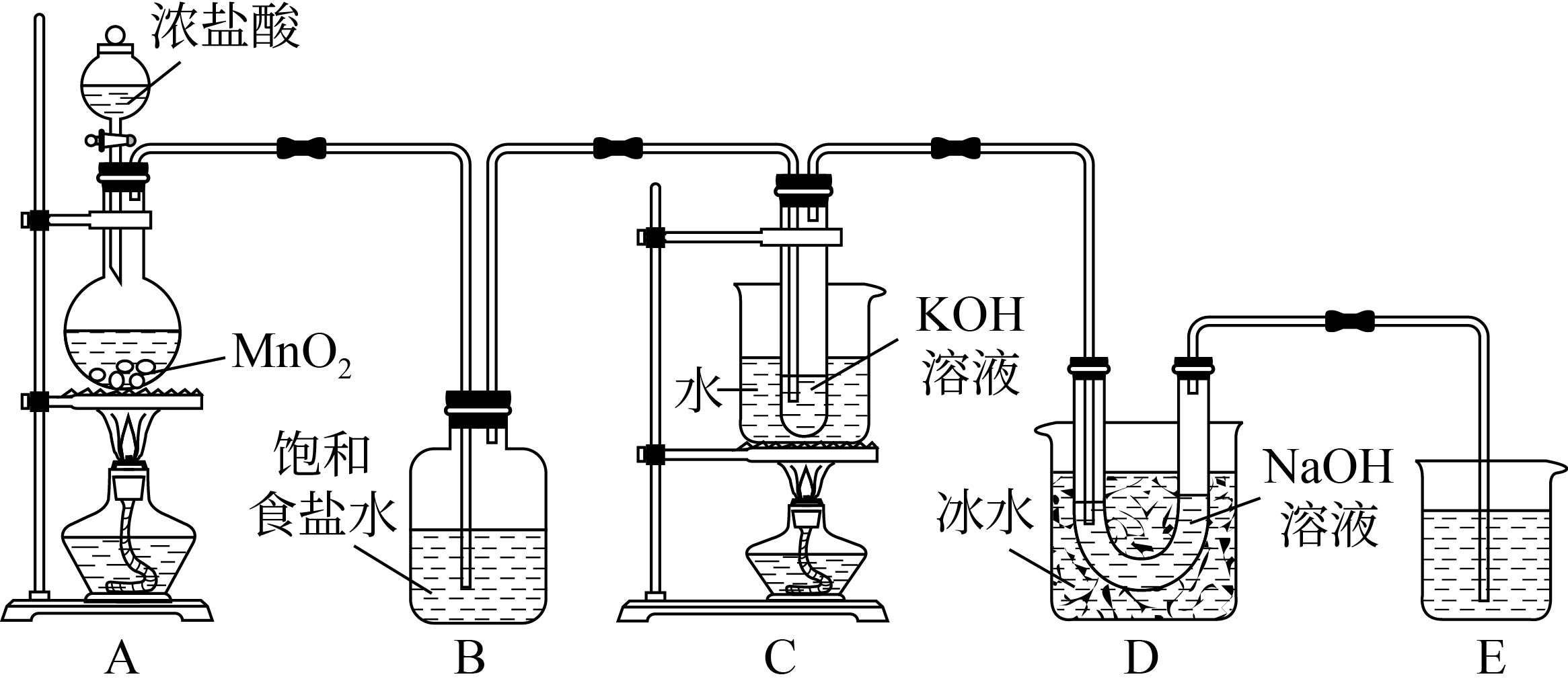
氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用图装置(部分装置省略)制备$\rm KCl{{O}_{3}}$和$\rm NaClO$,并探究$\rm NaClO$的性质。
回答下列问题:
A中反应的化学方程式是 。
A装置是用来制取氯气的,A中浓盐酸与二氧化锰在加热条件下反应生成氯气和氯化锰和水,反应方程式:$\rm Mn{{O}_{2}}+4HCl\begin{matrix} \underline{\underline{\triangle }} \\ {} \\\end{matrix}MnC{{l}_{2}}+2{{H}_{2}}O+C{{l}_{2}}\uparrow $。
B的作用是除去挥发出的$\rm HCl$气体。$\rm HCl$的电子式为 。
![]()
$\rm HCl$为共价化合物,氯化氢的电子式是:![]() 。
。
C中反应的离子方程式为:$\rm C{{l}_{2}}+O{{H}^{-}}\begin{matrix} \underline{\underline{\triangle }} \\ {} \\\end{matrix}ClO_{3}^{-}+$ $\rm +$ 。
$\rm C$用来制取$\rm KCl{{O}_{3}}$,反应的方程式为$\rm 3C{{l}_{2}}+6KOH\begin{matrix} \underline{\underline{\triangle }} \\ {} \\\end{matrix}KCl{{O}_{3}}+5KCl+3{{H}_{2}}O$,改写成离子方程式:$\rm 3C{{l}_{2}}+6O{{H}^{-}}\begin{matrix} \underline{\underline{\triangle }} \\ {} \\\end{matrix}ClO_{3}^{-}+5C{{l}^{-}}+3{{H}_{2}}O$。
D中采用冰水浴冷却的目的是 。
氢氧化钠与氯气反应有多种情况,温度高时生成$\rm NaCl{{O}_{3}}$,采用冰水浴冷却的目的是:避免生成$\rm NaCl{{O}_{3}}$,提高产品的纯度。
探究$\rm NaClO$的性质。
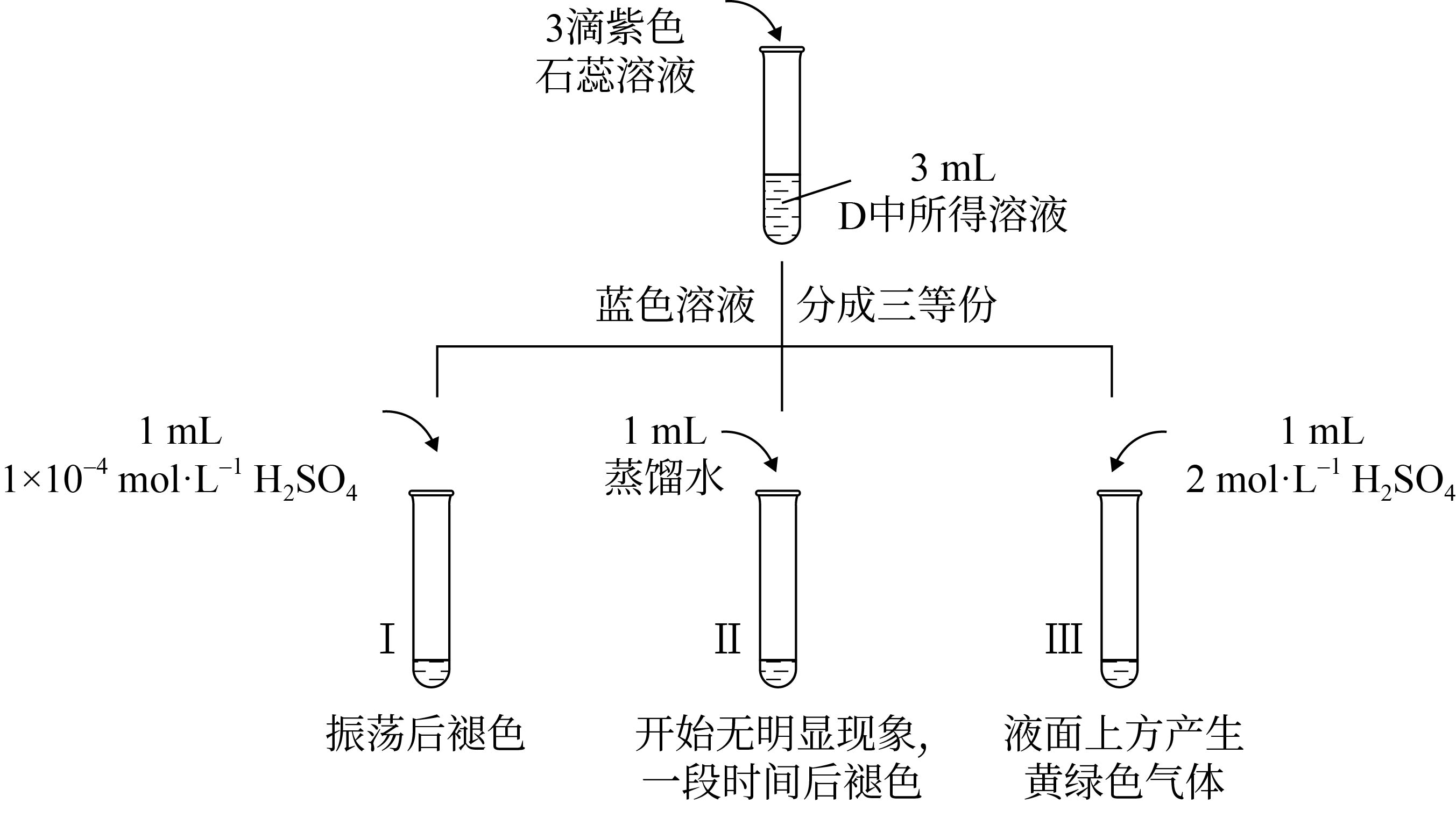
①Ⅰ中溶液褪色的原因是 。
②Ⅲ中产生黄绿色气体的原因是 。(写离子方程式)
①弱酸性环进行,次氯酸根离子具有漂白性,导致I中溶液褪色;
②次氯根离子与氯离子在强酸性环境下反应生成氯气,离子方程式:$\rm Cl{{O}^{-}}+C{{l}^{-}}+2{{H}^{+}}=C{{l}_{2}}\uparrow +{{H}_{2}}O$,因此有黄绿色气体$\rm C{{l}_{2}}$产生。
通过上述实验可知,影响氧化还原反应的因素有 。
比较实验I、II、III可知,变化的量是$\rm {{H}^{+}}$的浓度,即影响氧化还原反应的因素有离子的浓度。
高中 | 氯气的制法题目答案及解析(完整版)
