高中 | 氧化还原反应的计算 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应的计算题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应的计算
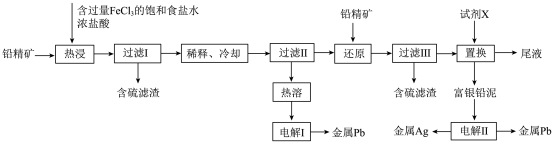
以铅精矿(含$\rm PbS$,$\rm A{{g}_{2}}S$等)为主要原料提取金属$\rm Pb$和$\rm Ag$的工艺流程如下:
回答下列问题:
“热浸”时,难溶的$\rm PbS$和$\rm A{{g}_{2}}S$转化为$\rm {{[PbC{{l}_{4}}]}^{2-}}$和$\rm {{[AgC{{l}_{2}}]}^{-}}$及单质硫。溶解等物质的量的$\rm PbS$和$\rm A{{g}_{2}}S$时,消耗$\rm F{{e}^{3+}}$物质的量之比为 ;溶液中盐酸浓度不宜过大,除防止“热浸”时$\rm HCl$挥发外,另一目的是防止产生 (填化学式)。
“热浸”时,$\rm F{{e}^{3+}}$将$\rm PbS$和$\rm A{{g}_{2}}S$中$\rm -2$价的硫氧化为单质硫,$\rm F{{e}^{3+}}$被还原为$\rm Fe^{2+}$,在这个过程中$\rm Pb$和$\rm Ag$的化合价保持不变,所以等物质的量的$\rm PbS$和$\rm A{{g}_{2}}S$时,$\rm S^{2-}$物质的量相等,所以消耗$\rm F{{e}^{3+}}$的物质的量相等,比值为$\rm 1:1$;溶液中盐酸浓度过大,这里主要考虑氢离子浓度会过大,会生成$\rm H_{2}S$ 气体。
将“过滤Ⅱ”得到的$\rm PbC{{l}_{2}}$沉淀反复用饱和食盐水热溶,电解所得溶液可制备金属$\rm Pb$“电解$\rm I$”阳极产物用尾液吸收后在工艺中循环使用,利用该吸收液的操作单元为 。
“过滤Ⅱ”得到的$\rm PbC{{l}_{2}}$沉淀反复用饱和食盐水热溶,会溶解为$\rm {{[PbC{{l}_{4}}]}^{2-}}$,电解$\rm {{[PbC{{l}_{4}}]}^{2-}}$溶液制备金属$\rm Pb$,$\rm Pb$在阴极产生,阳极$\rm Cl^{-}$放电产生$\rm Cl_{2}$, 尾液成分为$\rm FeCl_{2}$,$\rm FeCl_{2}$吸收$\rm Cl_{2}$后转化为$\rm FeCl_{3}$,可以在热浸中循环使用。
“还原”中加入铅精矿的目的是 。
过滤Ⅱ所得的滤液中有过量的未反应的$\rm Fe^{3+}$,根据还原之后可以得到含硫滤渣,“还原”中加入铅精矿的目的是是将将过量的$\rm Fe^{3+}$还原为$\rm Fe^{2+}$。
“置换”中可选用的试剂$\rm X$为 (填标号)。
$\rm A$.$\rm Al$ $\rm B$.$\rm Zn$ $\rm C$.$\rm Pb$ $\rm D$.$\rm Ag$
“置换”反应的离子方程式为 。
“置换”中加入试剂$\rm X$可以可以得到富银铅泥,为了防止引入其他杂质,则试剂$\rm X$应为$\rm Pb$,发生的反应为:$\rm Pb+2{{[AgC{{l}_{2}}]}^{-}}=2Ag+{{[PbC{{l}_{4}}]}^{2-}}$。
“电解Ⅱ”中将富银铅泥制成电极板,用作 (填“阴极”或“阳极”)。
“电解$\rm II$”中将富银铅泥制成电极板,电解Ⅱ得到金属银和金属铅,将银和铅分离出来,所以不可能作为阴极,应作为阳极板,阳极放电视,银变成阳极泥而沉降下来,铅失电子为$\rm Pb^{2+}$,阴极得电子得到$\rm Pb$,所以电极板应作阳极。
高中 | 氧化还原反应的计算题目答案及解析(完整版)
