高中 | 可逆反应与不可逆反应的判断 题目答案及解析
稿件来源:高途
高中 | 可逆反应与不可逆反应的判断题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
可逆反应与不可逆反应的判断
工业生产中以黄铁矿$\rm ($主要成分为$\text{Fe}{{\text{S}}_{\text{2}}}$,其中硫的化合价为$\text{-1}$价$\rm )$为原料生产硫酸的流程如图所示,下列说法错误的是$(\quad\ \ \ \ )$
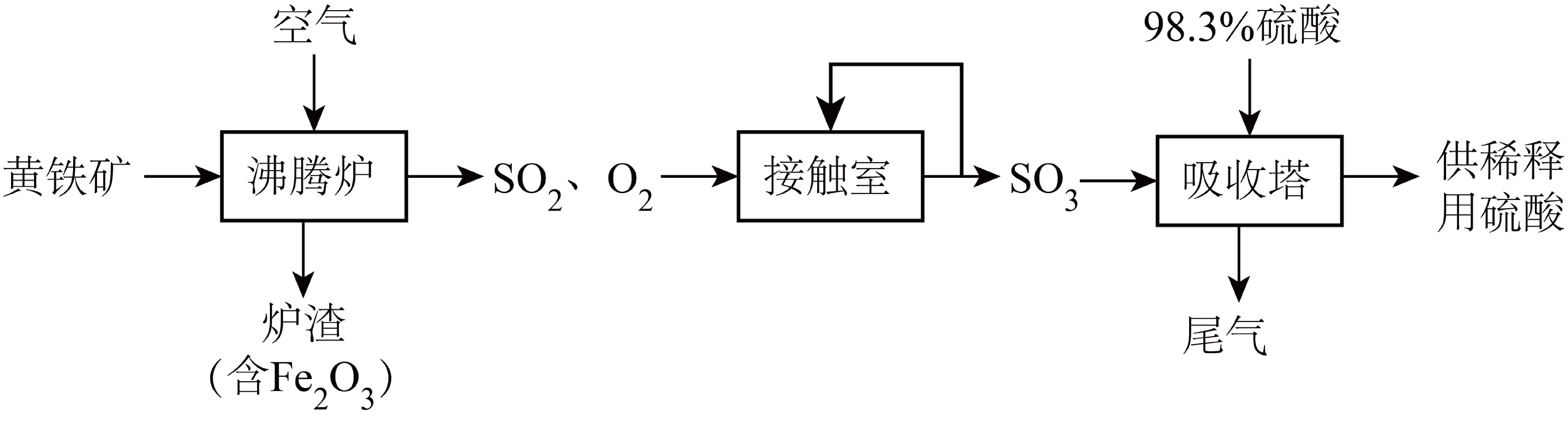
将黄铁矿粉碎,可以提高其在沸腾炉中的反应速率
","当$\\text{2 mol S}{{\\text{O}}_{\\text{2}}}$和$\\text{1 mol }{{\\text{O}}_{\\text{2}}}$进入接触室充分反应,将有$\\text{4 mol }{{\\text{e}}^{-}}$发生转移
","接触室中反应温度选择$\\text{400}\\sim \\text{500}\\ {}^\\circ \\text{C}$是为了提高催化剂活性并加快反应速率
","可用浓氨水吸收尾气,并将产物进一步转化利用
"]分析:黄铁矿在沸腾炉中与氧气反应生成氧化铁、二氧化硫,二氧化硫、氧气在接触室反应生成三氧化硫,三氧化硫在吸收塔中用$\rm 98.3\%$的浓硫酸吸收可生成硫酸,尾气含有二氧化硫、氧气;
$\rm A$.将黄铁矿粉碎,可以增大其与空气的接触面积,从而加快反应速率,$\rm A$正确;
$\rm B$.二氧化硫和氧气为可逆反应,进行不完全,则$\text{2 mol S}{{\text{O}}_{\text{2}}}$和$\text{1 mol }{{\text{O}}_{\text{2}}}$进入接触室充分反应,将有小于$\text{4 mol }{{\text{e}}^{-}}$发生转移,$\rm B$错误;
$\rm C$.升高温度反应加快,且催化剂需要一定的活化温度,接触室中反应温度选择$\text{400}\sim \text{500}\ {}^\circ \text{C}$是为了提高催化剂活性并加快反应速率,$\rm C$正确;
$\rm D$.尾气含有二氧化硫,用氨气吸收,可转化成氮肥,$\rm D$正确;
故选:$\rm B$
高中 | 可逆反应与不可逆反应的判断题目答案及解析(完整版)
