高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
$\rm I$.根据下列热化学反应方程式,回答问题:
①$\text{C}{{\text{O}}_{2}}\left( \text{g} \right)+4{{\text{H}}_{2}}\left( \text{g} \right)=\text{C}{{\text{H}}_{4}}\left( \text{g} \right)+2{{\text{H}}_{2}}\text{O}\left( \text{l} \right)\quad \Delta {{H}_{1}}=-252.9\text{ kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
②$2{{\text{H}}_{2}}\left( \text{g} \right)+{{\text{O}}_{2}}\left( \text{g} \right)=2{{\text{H}}_{2}}\text{O}\left( \text{l} \right)\quad \Delta {{H}_{2}}=-571.6\text{ kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
③$\text{C}\left( \text{s} \right)+\dfrac{1}{2}{{\text{O}}_{2}}\left( \text{g} \right)=\text{CO}\left( \text{g} \right)\quad \Delta {{H}_{3}}=-113.5\text{ kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
④$\text{CO}\left( \text{g} \right)+\dfrac{1}{2}{{\text{O}}_{2}}\left( \text{g} \right)=\text{C}{{\text{O}}_{2}}\left( \text{g} \right)\quad \Delta {{H}_{4}}=-283.0\text{ kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
⑤$2\text{S}{{\text{O}}_{2}}\left( \text{g} \right)+{{\text{O}}_{2}}\left( \text{g} \right)\rightleftharpoons 2\text{S}{{\text{O}}_{3}}\left( \text{g} \right)\,\quad \Delta {{H}_{5}}=-196.6\text{ kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
上述反应中,表示燃烧热的热化学方程式有 $\rm ($填序号$\rm )$,写出甲烷燃烧热的热化学方程式 。
④ ; $\\text{C}{{\\text{H}}_{4}}\\left( \\text{g} \\right)+2{{\\text{O}}_{2}}\\left( \\text{g} \\right)\\text{=C}{{\\text{O}}_{2}}\\left( \\text{g} \\right)+2{{\\text{H}}_{2}}\\text{O}\\left( \\text{l} \\right)\\quad \\Delta H=\\rm -890.3$ $\\text{kJ}\\cdot \\text{mo}{{\\text{l}}^{-1}}$
"]]燃烧热是指在$\rm 25$ $\rm ^\circ\rm C$,$\rm 101$ $\rm kPa$时,$\rm 1$ $\rm mol$纯物质完全燃烧生成稳定氧化物时所放出的热量,上述反应中,表示燃烧热的热化学方程式是④$\text{CO}\left( \text{g} \right)+\dfrac{1}{2}{{\text{O}}_{2}}\left( \text{g} \right)=\text{C}{{\text{O}}_{2}}\left( \text{g} \right)\quad \Delta {{H}_{\text{4}}}=-283.0\text{ kJ}\cdot \text{mo}{{\text{l}}^{-1}}$;由盖斯定律可知,②$\rm \times 2-$①可得甲烷燃烧热的热化学方程式为:$\text{C}{{\text{H}}_{4}}\left( \text{g} \right)+2{{\text{O}}_{2}}\left( \text{g} \right)\text{=C}{{\text{O}}_{2}}\left( \text{g} \right)+2{{\text{H}}_{2}}\text{O}\left( \text{l} \right)\quad \Delta H=2\Delta {{H}_{2}}-\Delta {{H}_{1}}=-2\times 571.6\text{ kJ}\cdot \text{mo}{{\text{l}}^{-1}}+252.9\text{ kJ}\cdot \text{mo}{{\text{l}}^{-1}}$ $\rm =-890.3$ $\text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$。
下列情况能说明反应⑤达到化学平衡状态的是 。
$\rm A$.${{v}_{正}}\left( {{\text{O}}_{2}} \right)=2{{v}_{逆}}\left( \text{S}{{\text{O}}_{2}} \right)$
$\rm B$.$\text{S}{{\text{O}}_{2}}$、${{\text{O}}_{2}}$、$\text{S}{{\text{O}}_{3}}$三者的浓度之比为$\rm 2$:$\rm 1$:$\rm 2$
$\rm C$.$\rm {{\text{O}}_{2}}$的物质的量不再改变
$\rm D$.恒温恒容时,混合气体的密度不改变
$\\rm C$
"]]$\rm A$.当$2{{v}_{正}}\left( {{\text{O}}_{2}} \right)={{v}_{逆}}\left( \text{S}{{\text{O}}_{2}} \right)$时反应达到平衡,${{v}_{正}}\left( {{\text{O}}_{\text{2}}} \right)=2{{v}_{逆}}\left( \text{S}{{\text{O}}_{\text{2}}} \right)$不能说明反应达到平衡,$\rm A$不选;
$\rm B$.$\rm \text{S}{{\text{O}}_{2}}$、$\rm {{\text{O}}_{2}}$、$\rm \text{S}{{\text{O}}_{3}}$三者的浓度之比为$\rm 2$:$\rm 1$:$\rm 2$时,该反应不一定达到平衡状态,与反应初始物质的量和转化率有关,所以不能据此判断平衡状态,$\rm B$不选;
$\rm C$.$\rm {{\text{O}}_{2}}$的物质的量不再改变,说明说明正逆反应速率相等,反应达到平衡,$\rm C$选;
$\rm D$.恒温恒容时,该反应过程中气体总质量和总体积都是定值,混合气体的密度是定值,当混合气体的密度不改变时,不能说明反应达到平衡,$\rm D$不选;
故选:$\rm C$
在容积为$\rm 5$ $\rm L$的恒温密闭容器中通入$10\text{ mol S}{{\text{O}}_{2}}$和$10\text{ mol }{{\text{O}}_{2}}$,反应过程中部分物质的物质的量随反应时间的变化如图所示。
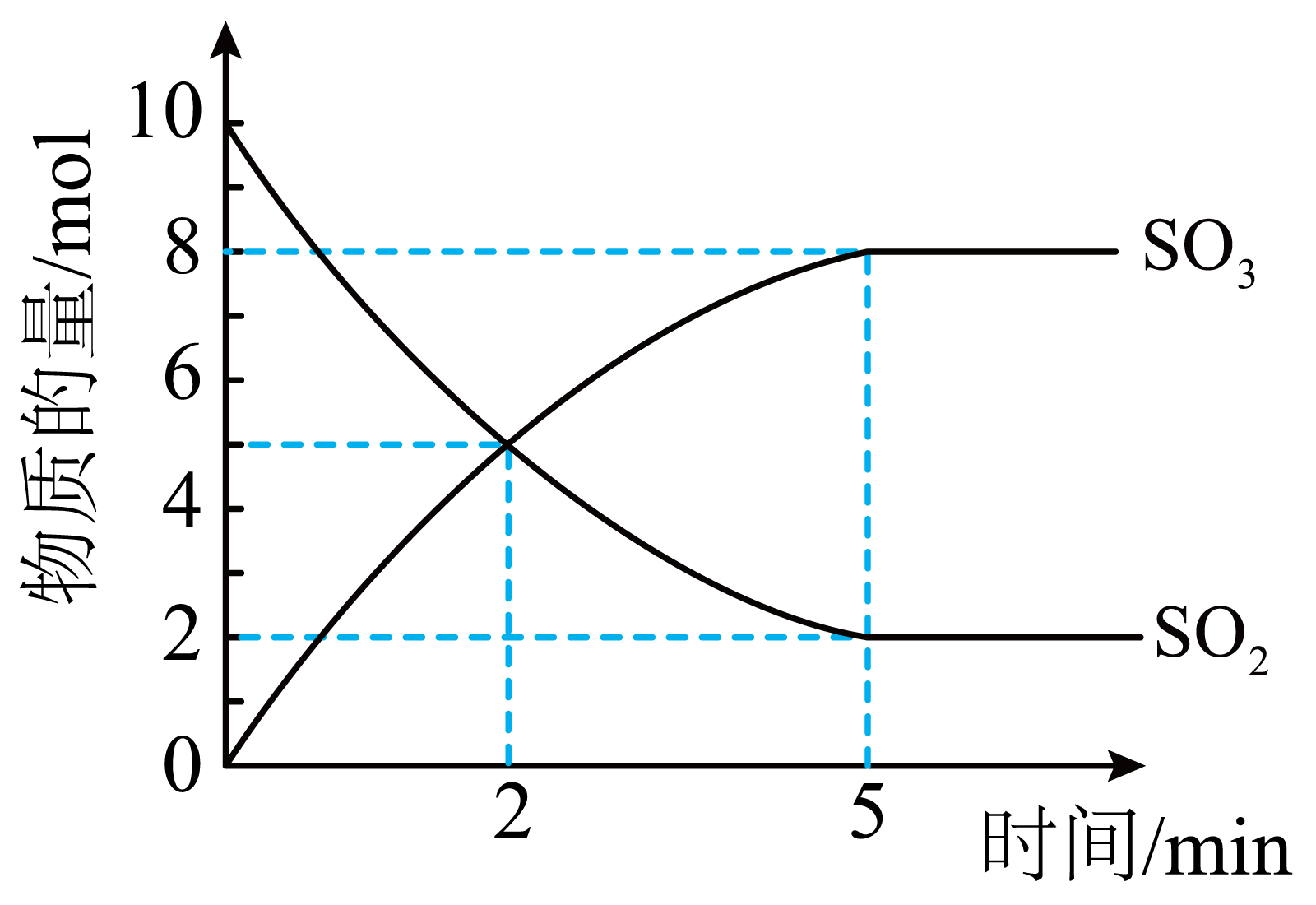
①$2\text{ min}$时,${{v}_{正}}\left( \text{S}{{\text{O}}_{3}} \right)$ ${{v}_{逆}}\left( \text{S}{{\text{O}}_{3}} \right)\rm ($填“$\rm \gt $”“$\lt $”或“$\rm =$”$\rm )$。
②$0\sim 5\text{ min}$内$v\left( {{\text{O}}_{2}} \right)=$ $\text{mol}\cdot {{\text{L}}^{-1}}\cdot {{\min }^{-1}}$。
$\\rm \\gt $ ; $\\rm 0.16$
"]]①$2\text{ min}$后,$\text{S}{{\text{O}}_{2}}$的物质的量仍在减小,$\text{S}{{\text{O}}_{3}}$的物质的量仍在增大,说明$2\text{ min}$时反应正向进行,${{v}_{正}}\left( \text{S}{{\text{O}}_{3}} \right) \gt {{v}_{逆}}\left( \text{S}{{\text{O}}_{3}} \right)$;
②$0\sim 5\text{ min}$内$v\left( {{\text{O}}_{2}} \right)=\dfrac{1}{2}v\left( \text{S}{{\text{O}}_{2}} \right)=\dfrac{1}{2}\times \dfrac{\text{10 mol-2 mol}}{\text{5 L}\times \text{5 min}}=0.16\text{ mol}\cdot {{\text{L}}^{-1}}\cdot {{\min }^{-1}}$。
Ⅱ$\rm .25$ $\rm ^\circ\rm C$时,部分弱电解质的电离平衡常数如下表所示:
| 弱酸 | $\text{C}{{\text{H}}_{3}}\text{COOH}$ | ${{\text{H}}_{2}}\text{C}{{\text{O}}_{3}}$ | $\text{HCN}$ |
| 电离常数 | ${{K}_{\text{a}}}=1.75\times {{10}^{-5}}$ | ${{K}_{\text{a}1}}=4.5\times {{10}^{-7}}$,${{K}_{\text{a}2}}=4.7\times {{10}^{-11}}$ | ${{K}_{\text{a}}}=6.2\times {{10}^{-10}}$ |
请回答下列问题:
$\text{HCO}_{3}^{-}$的电离平衡常数表达式为${{K}_{\text{a}}}=$ 。
${{{K}}_{\\text{a}}}=\\dfrac{{c}\\left( {{\\text{H}}^{+}} \\right){c}\\left( \\text{CO}_{\\text{3}}^{\\text{2-}} \\right)}{{c}\\left( \\text{HCO}_{\\text{3}}^{-} \\right)}$
"]]$\text{HCO}_{3}^{-}$的电离平衡常数表达式为${{{K}}_{\text{a}}}=\dfrac{{c}\left( {{\text{H}}^{+}} \right){c}\left( \text{CO}_{\text{3}}^{\text{2-}} \right)}{{c}\left( \text{HCO}_{\text{3}}^{-} \right)}$。
少量$\text{C}{{\text{O}}_{2}}$通入足量$\text{NaCN}$溶液中,反应的离子方程式为 。
${{\\text{H}}_{\\text{2}}}\\text{C}{{\\text{O}}_{\\text{3}}}\\text{+C}{{\\text{N}}^{-}}=\\text{HCN+HCO}_{\\text{3}}^{-}$
"]]酸的电离常数越大,酸性越强,由表格数据可知,酸性:${{\text{H}}_{2}}\text{C}{{\text{O}}_{3}}\rm \gt \text{HCN}\rm \gt \text{HCO}_{3}^{-}$,少量$\text{C}{{\text{O}}_{2}}$通入足量$\text{NaCN}$溶液中,根据强酸制取弱酸的原理可知,生成$\rm HCN$和$\rm NaHCO_{3}$,离子方程式为:${{\text{H}}_{\text{2}}}\text{C}{{\text{O}}_{\text{3}}}\text{+C}{{\text{N}}^{-}}=\text{HCN+HCO}_{\text{3}}^{-}$。
物质的量浓度均为$0.1\text{ mol}\cdot {{\text{L}}^{-1}}$的四种溶液:①$\text{C}{{\text{H}}_{3}}\text{COOH}$、②$\text{NaHC}{{\text{O}}_{3}}$、③$\text{N}{{\text{a}}_{2}}\text{C}{{\text{O}}_{3}}$、④$\text{NaCN}$,$\text{pH}$由小到大的排列顺序是 $\rm ($用序号表示$\rm )$。
③$\\rm \\gt $④$\\rm \\gt $②$\\rm \\gt $①
"]]物质的量浓度均为$0.1\text{ mol}\cdot {{\text{L}}^{-1}}$的四种溶液中$\text{C}{{\text{H}}_{3}}\text{COOH}$是酸,溶液中氢离子浓度最大,$\rm pH$最小,相同物质的量浓度的钠盐溶液,对应的酸的酸性越弱,则酸根离子水解程度越大,其溶液的$\rm pH$越大,由表格数据可知酸性:${{\text{H}}_{2}}\text{C}{{\text{O}}_{3}}\rm \gt \text{HCN}\rm \gt \text{HCO}_{3}^{-}$,则水解程度:$\text{CO}_{3}^{2-}\rm \gt \text{C}{{\text{N}}^{-}}\rm \gt \text{HCO}_{3}^{-}$,则$\rm pH$由大到小的顺序为③$\rm \gt $④$\rm \gt $②$\rm \gt $①。
$0.2\text{ mol}\cdot {{\text{L}}^{-1}}\text{ HCN}$溶液与$0.1\text{ mol}\cdot {{\text{L}}^{-1}}\text{ NaOH}$溶液等体积混合后,溶液显 性$\rm ($填“酸”“碱”或“中”$\rm )$。
碱
"]]将$\rm 0.2$ $\rm mol/L$的$\rm HCN$溶液和$\rm 0.1$ $\rm mol/L$的$\rm NaOH$溶液等体积混合,溶液中的溶质是等物质的量浓度的$\rm NaCN$、$\rm HCN$,由表格数据可知,${{K}_{\text{a}}}\left( \text{HCN} \right)\lt {{K}_{\text{h}}}\text{(C}{{\text{N}}^{-}})=\dfrac{{{K}_{\text{W}}}}{{{K}_{\text{a}}}\left( \text{HCN} \right)}=\dfrac{{{10}^{-14}}}{6.2\times {{10}^{-10}}}$,$\rm HCN$的电离程度小于$\text{C}{{\text{N}}^{-}}$的水解程度,溶液显碱性。
已知$T\ {}^\circ \text{C}$时,${{K}_{\text{sp}}}\left( \text{CuCN} \right)=1\times {{10}^{-20}},{{K}_{\text{sp}}}\left( \text{C}{{\text{u}}_{2}}\text{S} \right)=2\times {{10}^{-48}}$,则$T\ {}^\circ \text{C}$下,反应$2\text{CuCN}\left( \text{s} \right)+{{\text{S}}^{2-}}\left( \text{aq} \right)\rightleftharpoons \text{C}{{\text{u}}_{2}}\text{S}\left( \text{s} \right)+2\text{C}{{\text{N}}^{-}}\left( \text{aq} \right)$的平衡常数$K=$ 。
$5\\times {{10}^{7}}$
"]]反应$2\text{CuCN}\left( \text{s} \right)+{{\text{S}}^{2-}}\left( \text{aq} \right)\rightleftharpoons \text{C}{{\text{u}}_{2}}\text{S}\left( \text{s} \right)+2\text{C}{{\text{N}}^{-}}\left( \text{aq} \right)$的平衡常数$K=\dfrac{{{c}^{2}}\left(\rm C{\rm {N}^{-}} \right)}{c\left( {{\text{S}}^{2-}} \right)}=\dfrac{{{c}^{2}}\left( \rm C{\rm {N}^{-}} \right){{c}^{2}}\left(\rm C{{u}^{2+}} \right)}{c\left( {{\text{S}}^{2-}} \right){{c}^{2}}\left( \rm C{{u}^{2+}} \right)} =\dfrac{{{\left[ {{K}_{\text{sp}}}\left( \text{CuCN} \right) \right]}^{\text{2}}}}{{{K}_{\text{sp}}}\left( \text{C}{{\text{u}}_{\text{2}}}\text{S} \right)}=\dfrac{{{\left( 1\times {{10}^{-20}} \right)}^{2}}}{2\times {{10}^{-48}}}=5\times {{10}^{7}}$。
高中 | 化学平衡常数题目答案及解析(完整版)
高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
1、.根据下列热化学反应方程式,回答问题:
①
②
③
④
⑤
1.1、上述反应中,表示燃烧热的热化学方程式有 填序号
,写出甲烷燃烧热的热化学方程式 。
1.2、下列情况能说明反应⑤达到化学平衡状态的是 。
.
.
、
、
三者的浓度之比为
:
:
.
的物质的量不再改变
.恒温恒容时,混合气体的密度不改变
1.3、在容积为
的恒温密闭容器中通入
和
,反应过程中部分物质的物质的量随反应时间的变化如图所示。

①时,
填“
”“
”或“
”
。
②内
。
1.4、Ⅱ
时,部分弱电解质的电离平衡常数如下表所示:
| 弱酸 | |||
| 电离常数 |
请回答下列问题:
的电离平衡常数表达式为
。
1.5、少量通入足量
溶液中,反应的离子方程式为 。
1.6、物质的量浓度均为的四种溶液:①
、②
、③
、④
,
由小到大的排列顺序是
用序号表示
。
1.7、溶液与
溶液等体积混合后,溶液显 性
填“酸”“碱”或“中”
。
1.8、已知时,
,则
下,反应
的平衡常数
。
高中 | 化学平衡常数题目答案及解析(完整版)
免责声明:
① 凡本站注明“稿件来源:高途”的所有文字、图片和音视频稿件,版权均属本网所有,任何媒体、网站或个人未经本网协议授权不得转载、链接、转贴或以其他方式复制发表。已经本站协议授权的媒体、网站,在下载使用时必须注明“稿件来源:高途”,违者本站将依法追究责任。
② 本站注明稿件来源为网络的文/图等稿件均为转载稿,本站转载出于非商业性的教育和科研之目的,并不意味着赞同其观点或证实其内容的真实性。如转载稿涉及版权等问题,请作者在两周内速来电或来函联系。
甲醇汽油是一种新能源清洁燃料,可以作为汽油的替代物。将转化为甲醇,既可减少的排放,又可节约能源,转化过程涉及如下反应:
异丁醇催化脱水制备异丁烯主要涉及以下个反应。研究一定压强下不同含水量的异丁醇在恒压反应器中的脱水反应,得到了异丁烯的平衡产率随温度的变化结果如图。
利用页岩气中丰富的丙烷制丙烯已成为化工原料丙烯生产的重要渠道。
合成氨是人类科技发展史上的一项重大突破。
利用页岩气中丰富的丙烷制丙烯已成为化工原料丙烯生产的重要渠道。
某小组欲制备配离子,实验如下。




