高中 | 离子方程式 题目答案及解析
稿件来源:高途
高中 | 离子方程式题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第二节 离子反应
离子方程式
向两份等体积、$\rm pH$不同的$\rm FeS{{O}_{4}}$溶液中逐滴加入$\rm NaClO$溶液,实验测得溶液$\rm pH$随加入$\rm NaClO$溶液体积变化曲线如下图,实验现象如下表。下列说法不正确的是$\rm (\qquad)$
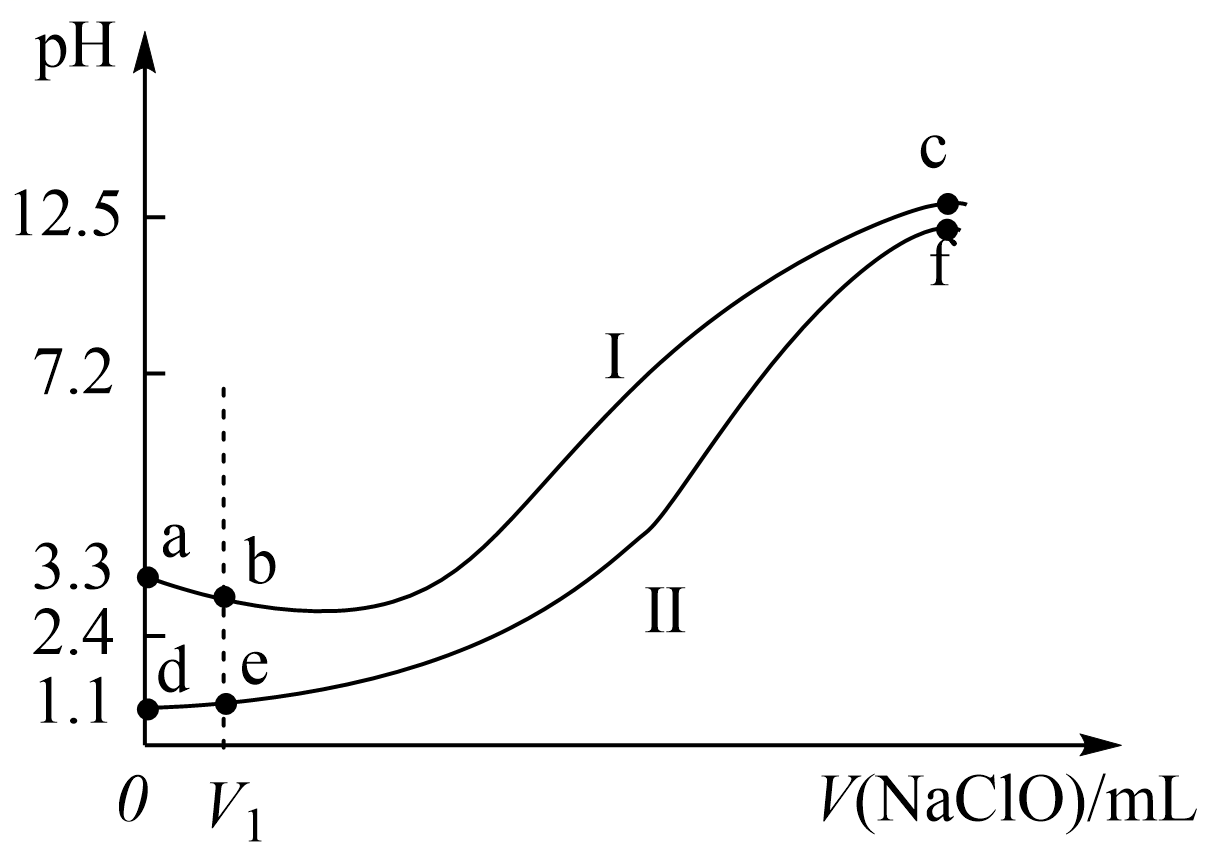
| 实验 | 实验现象 |
| Ⅰ | 滴入${{V}_{1}}\ \rm mL\ NaClO$溶液产生大量红褐色沉淀 |
| Ⅱ | 滴入${{V}_{1}}\ \rm mL\ NaClO$溶液,溶液变黄,未见沉淀,继续滴加出现红褐色沉淀 |
$\\rm a\\sim b$段主要反应的离子方程式为$\\rm 2F{{e}^{2+}}+Cl{{O}^{-}}+5{{H}_{2}}O=2Fe{{(OH)}_{3}}\\downarrow +C{{l}^{-}}+4{{H}^{+}}$
","$\\rm d\\sim e$段主要反应的离子方程式为$\\rm Cl{{O}^{-}}+{{H}^{+}}\\rightleftharpoons HClO$
","$\\rm c$、$\\rm f$点$\\rm pH$接近的主要原因是$\\rm Cl{{O}^{-}}+{{H}_{2}}O\\rightleftharpoons HClO+O{{H}^{-}}$
","向$\\rm c$点溶液中加入过量的浓盐酸,沉淀溶解并有刺激性气味的气体放出
"]$\rm A$.$\rm a\sim b$段生成红褐色沉淀,即生成了氢氧化铁沉淀,反应的离子方程式为:$\rm 2Fe^{2+}+ClO^{-}+5H_{2}O=2Fe(OH)_{3}↓+Cl^{-}+4H^{+}$,故$\rm A$正确;
$\rm B$.$\rm d\sim e$段溶液变黄,说明生成铁离子,反应的离子方程式为:$\rm 2Fe^{2+}+ClO^{-}+2H^{+}=2Fe^{3+}+Cl^{-}+H_{2}O$,故$\rm B$错误;
$\rm C$.$\rm c$、$\rm f$点$\rm NaClO$过量,$\rm NaClO$水解溶液显碱性,水解的离子方程式为:$\rm Cl{{O}^{-}}+{{H}_{2}}O\rightleftharpoons HClO+O{{H}^{-}}$,故$\rm C$正确;
$\rm D$.盐酸与氢氧化铁反应生成氯化铁,盐酸与次氯酸钠反应生成氯气,所以加过量的盐酸,沉淀溶解并有刺激性气味的气体放出,故$\rm D$正确;
故选:$\rm B$
高中 | 离子方程式题目答案及解析(完整版)
