高中 | 原电池工作原理 题目答案及解析
稿件来源:高途
高中 | 原电池工作原理题目答案及解析如下,仅供参考!
选修四
第四章 电化学基础
第一节 原电池
原电池工作原理
某小组同学探究物质的溶解度大小与沉淀转化方向之间的关系。
已知:
| 物质 | $\text{BaS}{{\text{O}}_{4}}$ | $\text{BaC}{{\text{O}}_{3}}$ | $\text{AgI}$ | $\text{AgCl}$ |
| 溶解度$\rm /\text{g(20}\text{)}$ | $2.4\times {{10}^{-4}}$ | $1.4\times {{10}^{-3}}$ | $3.0\times {{10}^{-7}}$ | $1.5\times {{10}^{-4}}$ |
探究$\text{BaC}{{\text{O}}_{3}}$和$\text{BaS}{{\text{O}}_{4}}$之间的转化
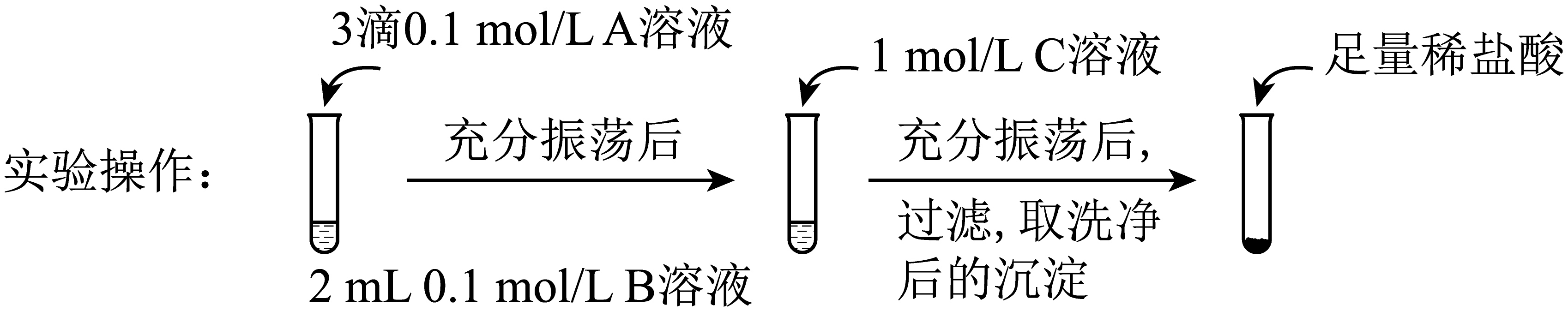
| 试剂$\rm A$ | 试剂$\rm B$ | 试剂$\rm C$ | 加入盐酸后的现象 | |
| 实验Ⅰ | $\text{BaC}{{\text{l}}_{2}}$ | $\text{N}{{\text{a}}_{2}}\text{C}{{\text{O}}_{3}}$ | $\text{N}{{\text{a}}_{2}}\text{S}{{\text{O}}_{4}}$ | …… |
| 实验Ⅱ | $\text{N}{{\text{a}}_{2}}\text{S}{{\text{O}}_{4}}$ | $\text{N}{{\text{a}}_{2}}\text{C}{{\text{O}}_{3}}$ | 有少量气泡产生,沉淀部分溶解 |
①实验Ⅰ说明$\text{BaC}{{\text{O}}_{3}}$全部转化为$\text{BaS}{{\text{O}}_{4}}$,依据的现象是加入盐酸后, 。
②实验Ⅱ中加入稀盐酸后发生反应的离子方程式是 。
③实验Ⅱ说明沉淀发生了部分转化,结合$\text{BaS}{{\text{O}}_{4}}$的沉淀溶解平衡解释原因: 。
无气泡产生、沉淀不溶解$\\rm ($或无明显现象$\\rm )$ ; $\\rm BaCO_{3}+2H^{+}=Ba^{2+}+CO_{2}↑+H_{2}O$ ; $\\text{BaS}{{\\text{O}}_{4}}$在溶液中存在$\\rm BaSO_{4}(s)\\rightleftharpoons \\rm Ba^{2+}(aq)+\\text{SO}_{4}^{2-}\\rm (aq)$,当加入浓度较高的$\\rm Na_{2}CO_{3}$溶液,$\\text{CO}_{3}^{2-}$与$\\rm Ba^{2+}$结合生成$\\rm BaCO_{3}$沉淀,$\\rm c(Ba^{2+})$降低,使上述平衡向右移动
"]]①实验Ⅰ中若$\rm BaCO_{3}$全部转化为$\rm BaSO_{4}$,$\rm BaSO_{4}$不与盐酸反应,因此向洗净后的沉淀中加入盐酸,沉淀不溶解$\rm ($没有明显现象$\rm )$;
②实验Ⅱ中加入稀盐酸后有少量气泡产生,沉淀部分溶解,说明沉淀中含有$\rm BaCO_{3}$,$\rm BaCO_{3}$与稀盐酸发生反应为$\rm BaCO_{3}+2H^{+}=Ba^{2+}$ $\rm +CO_{2}↑+H_{2}O$;
③由于$\rm BaSO_{4}$在溶液中存在溶解平衡:$\rm BaSO_{4}(s)\rightleftharpoons \rm Ba^{2+}(aq)+\text{SO}_{4}^{2-}\rm (aq)$,当加入浓度较高的$\rm Na_{2}CO_{3}$溶液后,$\rm CO_{\text{3}}^{\text{2}-}$与$\rm Ba^{2+}$结合生成$\rm BaCO_{3}$沉淀,使上述平衡正向移动,沉淀发生了部分转化;
探究$\text{AgCl}$和$\text{AgI}$之间的转化
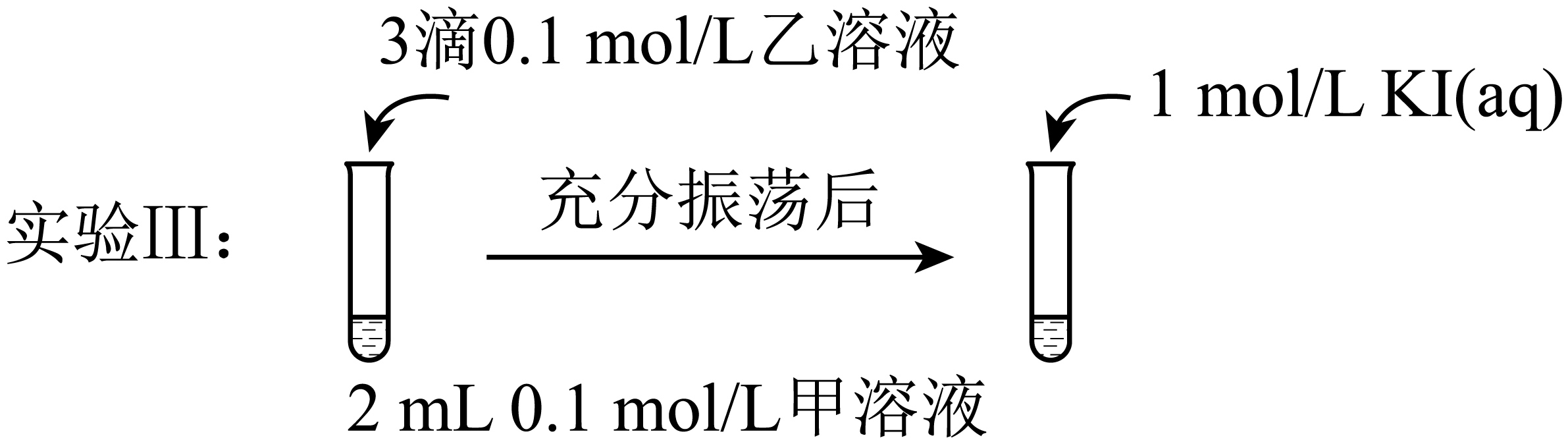
实验Ⅳ:在试管中进行溶液间反应时,同学们无法观察到$\text{AgI}$转化为$\text{AgCl}$,于是又设计了如下实验$\rm ($电压表读数:$\rm {a\gt c\gt b\gt 0}\rm )$。
| 装置 | 步骤 | 电压表读数 |
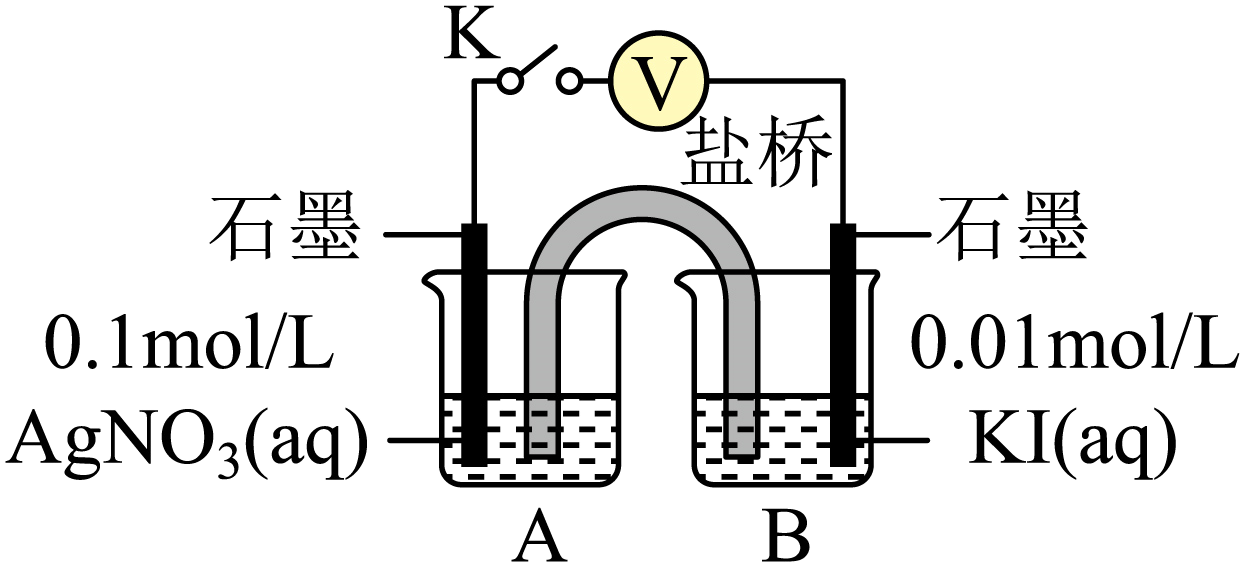 | $\rm i$.如图连接装置并加入试剂,闭合$\rm K$ | $\rm a$ |
| $\rm ii$.向$\rm B$中滴入$\text{AgN}{{\text{O}}_{3}}(\text{aq})$,至沉淀完全 | $\rm b$ | |
| $\rm iii$.再向$\rm B$中投入一定量$\text{NaCl}(\text{s})$ | $\rm c$ | |
| $\rm iv.$重复$\rm i$,再向$\rm B$中加入与ⅲ等量$\text{NaCl}(\text{s})$ | $\rm a$ |
注:其他条件不变时,参与原电池反应的氧化剂$\rm ($或还原剂$\rm )$的氧化性$\rm ($或还原性$\rm )$越强,原电池的电压越大;离子的氧化性$\rm ($或还原性$\rm )$强弱与其浓度有关。
①实验Ⅲ证明了$\rm \text{AgCl}$转化为$\rm \text{AgI}$,甲溶液可以是 $\rm ($填序号$\rm )$。
$\rm a$.$\rm \text{AgN}{{\text{O}}_{3}}$溶液 $\rm b$.$\rm \text{NaCl}$溶液 $\rm c$.$\rm \text{KI}$溶液
②实验Ⅳ的步骤$\rm i$中,$\rm B$中石墨上的电极反应式是 。
③结合信息,解释实验Ⅳ中$\text{b}\lt \text{a}$的原因: 。
④实验Ⅳ中步骤$\rm iv$的目的是 。
⑤实验Ⅳ的现象能说明$\text{AgI}$转化为$\text{AgCl}$,理由是 。
$\\rm b$ ; $\\rm 2I^{-}-2e^{-}=$ $\\rm I_{2}$ ; 由于生成$\\rm AgI$沉淀使$\\rm B$的溶液中$c\\left( {{\\text{I}}^{-}} \\right)$减小,$\\rm I^{-}$还原性减弱 ; 证明加入$\\rm Cl^{-}$对该原电池电压无影响 ; $\\text{c}\\gt \\text{b}$说明加入$\\rm Cl^{-}$使$c\\left( {{\\text{I}}^{-}} \\right)$增大,证明发生了$\\rm AgI$ $\\rm +$ $\\rm Cl^{-}\\rightleftharpoons AgCl$ $\\rm +$ $\\rm I^{-}$
"]]①实验Ⅲ中最后加入的是$\rm 0.1\;\rm mol/LKI$溶液,应该是探究$\rm AgCl$转化成$\rm AgI$,且$\rm KI$能与$\rm AgNO_{3}$溶液直接反应生成$\rm AgI$沉淀,则加入的$\rm NaCl$溶液应该过量,即图中甲过量、乙不足,所以甲溶液是$\rm NaCl$溶液,故选:$\rm b$;
②实验Ⅳ的步骤$\rm i$中,$\rm B$中石墨上的碘离子失电子生成碘单质,电极反应式是 $\rm 2I^{-}-2e^{-}=$ $\rm I_{2}$;
③滴入$\rm AgNO_{3}(ag)$时生成$\rm AgI$沉淀,使装置$\rm B$中$c\left( {{\text{I}}^{-}} \right)$减小,$\rm I^{-}$还原性减弱,则实验Ⅳ中出现$\rm b\lt a$;
④重复步骤ⅰ,再向$B$中加入与ⅲ等量的$\rm NaCl(s)$,电压与步骤ⅰ相同,可以证明$Cl^{-}$对电压没有影响;
⑤根据步骤ⅰ、ⅳ可知,$Cl^{-}$本身对该原电池电压无影响,$\rm c\gt $$\rm b$说明加入$\rm Cl^{-}$使溶液中$c\left( {{\text{I}}^{-}} \right)$增大,证明发生了反应:$\rm AgI$ $\rm +$ $\rm Cl^{-}\rightleftharpoons AgCl$ $\rm +$ $\rm I^{-}$;
综合实验Ⅰ~Ⅳ,可得出结论: 。
溶解度小的沉淀容易转化成溶解度更小的沉淀,反之则不易;溶解度差别越大,由溶解度小的沉淀转化为溶解度较大的沉淀越难实现
"]]综合实验Ⅰ$\rm \sim $Ⅳ,可得出溶解度小的沉淀容易转化成溶解度更小的沉淀,反之则不易;溶解度差别越大,由溶解度小的沉淀转化为溶解度较大的沉淀越难实现。
高中 | 原电池工作原理题目答案及解析(完整版)
