高中 | 盐溶液微粒间的三大守恒原理的理解及应用 题目答案及解析
稿件来源:高途
高中 | 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析如下,仅供参考!
选修四
第三章 水溶液中的离子平衡
第三节 盐类的水解
盐溶液微粒间的三大守恒原理的理解及应用
尿素$\left[ \text{CO}{{\left( \text{N}{{\text{H}}_{2}} \right)}_{2}} \right]$合成的发展体现了化学科学与技术的不断进步。
十九世纪初,用氰酸银$\left( \text{AgOCN} \right)$与$\text{N}{{\text{H}}_{4}}\text{Cl}$在一定条件下反应制得$\text{CO}{{\left( \text{N}{{\text{H}}_{2}} \right)}_{2}}$,实现了由无机物到有机物的合成。该反应的化学方程式是 。
$\\text{AgOCN}+\\text{N}{{\\text{H}}_{4}}\\text{Cl}=\\text{CO}{{\\left( \\text{N}{{\\text{H}}_{2}} \\right)}_{2}}+\\text{AgCl}$
"]]根据原子守恒分析,二者反应生成尿素和氯化银,化学方程式是$\text{AgOCN}+\text{N}{{\text{H}}_{4}}\text{Cl}=\text{CO}{{\left( \text{N}{{\text{H}}_{2}} \right)}_{2}}+\text{AgCl}$。
二十世纪初,工业上以$\text{C}{{\text{O}}_{2}}$和$\text{N}{{\text{H}}_{3}}$为原料在一定温度和压强下合成尿素。反应分两步:
ⅰ。$\text{C}{{\text{O}}_{2}}$和$\text{N}{{\text{H}}_{3}}$生成$\text{N}{{\text{H}}_{2}}\text{COON}{{\text{H}}_{4}}$;
ⅱ。$\text{N}{{\text{H}}_{2}}\text{COON}{{\text{H}}_{4}}$分解生成尿素。

结合反应过程中能量变化示意图,下列说法正确的是 $\rm ($填序号$\rm )$。
$\rm a$.活化能:反应ⅰ$\rm \lt $反应ⅱ
$\rm b$.ⅰ为放热反应,ⅱ为吸热反应
$\rm c$.${\rm \text{C}{{\text{O}}_{2}}\left( \text{l} \right)+2\text{N}{{\text{H}}_{3}}\left( \text{l} \right)=\text{CO}{{\left( \text{N}{{\text{H}}_{2}} \right)}_{2}}\left( \text{l} \right)+{{\text{H}}_{2}}\text{O}\left( \text{l} \right)}\qquad\Delta { H}={{ {E}}_{1}}-{{ {E}}_{4}}$
$\\rm ab$
"]]$\rm a$.反应ⅰ的活化能是${{{E}}_{{1}}}$,反应ⅱ活化能是${{{E}}_{{3}}}$,${{{E}}_{{1}}}\lt {{{E}}_{{3}}}$,$\rm a$项正确;
$\rm b$.从图中反应物和生成物能量的相对大小可看出反应ⅰ放热,反应ⅱ吸热,$\rm b$项正确;
$\rm c$.总反应的:$ \Delta{ H=}{{{E}}_{{1}}}-{{{E}}_{{2}}}+{{{E}}_{{3}}}-{{{E}}_{{4}}}$,$\rm c$项错误。
近年研究发现,电催化$\text{C}{{\text{O}}_{2}}$和含氮物质$\rm (\text{NO}_{3}^{-}$等$\rm )$在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的$\text{KN}{{\text{O}}_{3}}$溶液通$\text{C}{{\text{O}}_{2}}$至饱和,在电极上反应生成$\text{CO}{{\left( \text{N}{{\text{H}}_{2}} \right)}_{2}}$,电解原理如图所示。

①电极$\text{b}$是电解池的 极。
②电解过程中生成尿素的电极反应式是 。
阳;$2\\text{NO}_{3}^{-}+16{{\\text{e}}^{-}}+\\text{C}{{\\text{O}}_{2}}+18{{\\text{H}}^{+}}=\\text{CO}{{\\left( \\text{N}{{\\text{H}}_{2}} \\right)}_{2}}+7{{\\text{H}}_{2}}\\text{O}$
"]]①电极$\rm b$上发生$\rm {{\text{H}}_{2}}\text{O}$失电子生成$\rm {{\text{O}}_{2}}$的氧化反应,是电解池的阳极。②$\rm a$极硝酸根离子得电子转化为尿素,再结合酸性环境可分析出电极反应式为$\rm 2\text{NO}_{3}^{-}+16{{\text{e}}^{-}}+\text{C}{{\text{O}}_{2}}+18{{\text{H}}^{+}}=\text{CO}{{\left( \text{N}{{\text{H}}_{2}} \right)}_{2}}+7{{\text{H}}_{2}}\text{O}$。
尿素样品含氮量的测定方法如下。
已知:溶液中$ {c}\left( \text{NH}_{4}^{+} \right)$不能直接用$\text{NaOH}$溶液准确滴定。
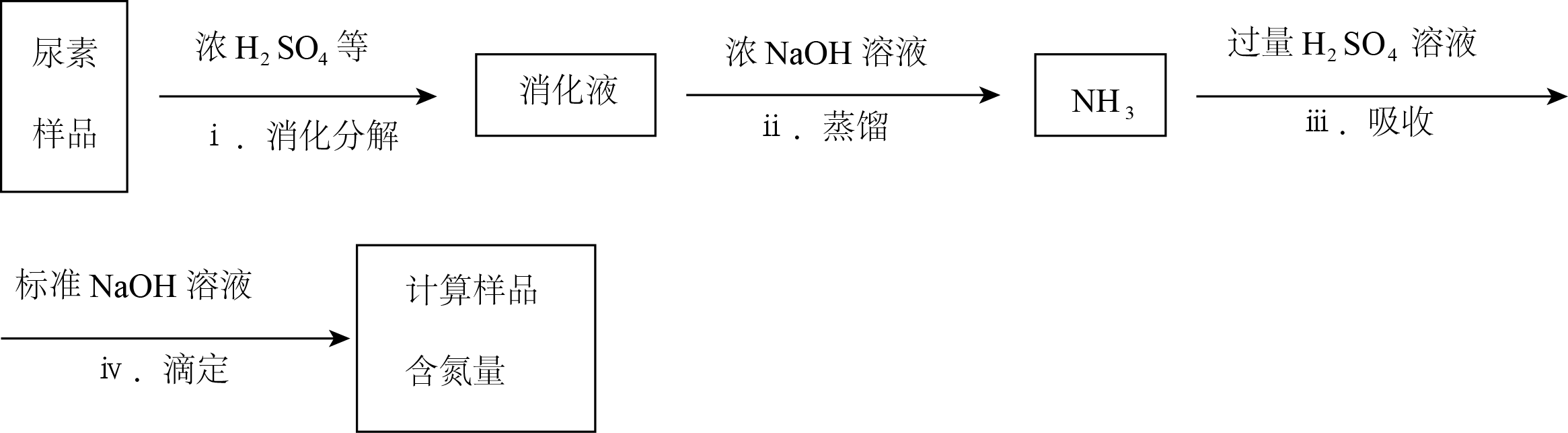
①消化液中的含氮粒子是 。
②步骤ⅳ中标准$\text{NaOH}$溶液的浓度和消耗的体积分别为$ {c}$和$ {V}$,计算样品含氮量还需要的实验数据有 。
$\\text{NH}_{4}^{+}$;样品的质量、步骤Ⅲ所加入${{\\text{H}}_{2}}\\text{S}{{\\text{O}}_{4}}$溶液的体积和浓度
"]]①尿素消化分解生成$\text{N}{{\text{H}}_{\text{3}}}$和$\text{C}{{\text{O}}_{\text{2}}}$,由于反应中存在浓${{\text{H}}_{2}}\text{S}{{\text{O}}_{4}}$,则消化液中含氮粒子为$\text{NH}_{4}^{+}$。②除了已知数据外,还需要的是样品的质量、步骤ⅲ所加入${{\text{H}}_{2}}\text{S}{{\text{O}}_{4}}$溶液的体积和浓度。
高中 | 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析(完整版)
