高中 | 化学平衡图像分析 题目答案及解析
稿件来源:高途
高中 | 化学平衡图像分析题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡图像分析
$\rm C{{O}_{2}}$资源化利用是解决资源和能源短缺、减少碳排放的一种途径。
$\rm I$.$\rm C{{O}_{2}}$制甲醇,过程如下:
$\rm i$.催化剂活化:$\rm I{{n}_{2}}{{O}_{3}}($无活性$ )\overset{还原}{\underset{氧化}{\rightleftharpoons}}{\rm In}_{2}{\rm O}_{3-x}($有活性$\rm )$
$\rm ii$.$\rm C{{O}_{2}}$与$\rm {{H}_{2}}$在活化后的催化剂表面可逆的发生反应①,其反应历程如图。同时伴随反应②:${\rm C{{O}_{2}}(g)+{{H}_{2}}(g)\rightleftharpoons CO(g)+{{H}_{2}}O(g)}\quad\Delta H=+41.2\rm \ kJ/mol$。
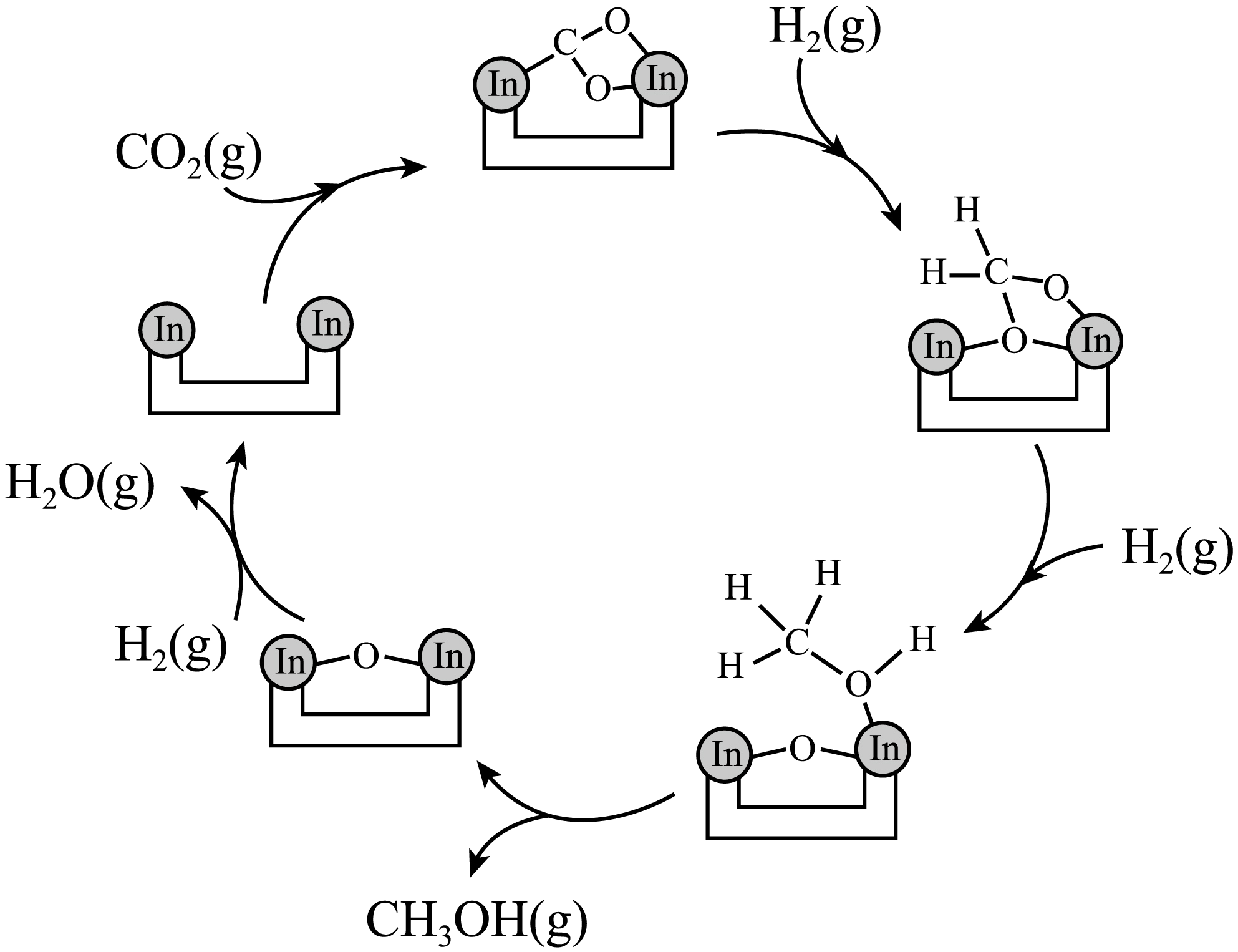
反应①每生成$\rm 1\ mol\ C{{H}_{3}}OH(g)$放热$\rm 49.3\ kJ$,写出其热化学方程式: 。
${\\rm C{{O}_{2}}(g)+3{{H}_{2}}(g)=C{{H}_{3}}OH(g)+{{H}_{2}}O(g)}\\quad \\Delta H=-49.3\\rm \\ kJ/mol$
"]]反应①中$\rm CO_{2}$和$\rm H_{2}$在温和的条件下转化为甲醇和$\rm H_{2}O$,每生成$\rm 1\ mol\ CH_{3}OH(g)$放热$\rm 49.3\ kJ$,其热化学方程式为${\rm C{{O}_{2}}(g)+3{{H}_{2}}(g)=C{{H}_{3}}OH(g)+{{H}_{2}}O(g)}\quad\Delta H=-49.3\rm \ kJ/mol$。
$\rm C{{O}_{2}}$与$\rm {{H}_{2}}$混合气体以不同的流速通过反应器,气体流速与$\rm C{{O}_{2}}$转化率、$\rm C{{H}_{3}}OH$选择性的关系如图。
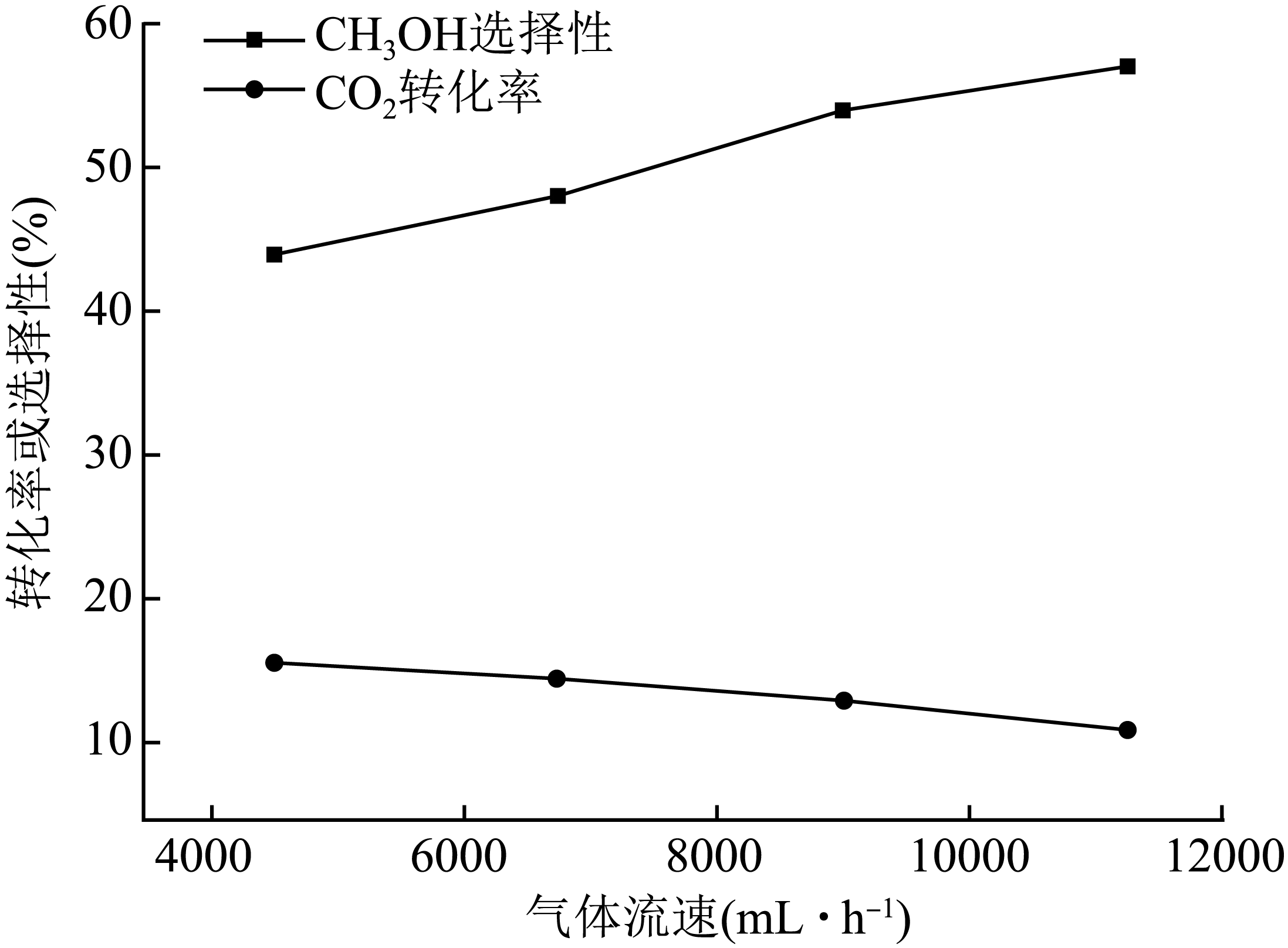
已知:$\rm C{{H}_{3}}OH$选择性$=n{\rm (生成C{{H}_{3}}OH所用的C{{O}_{2}})}/n{\rm (转化的C{{O}_{2}})}$。
流速加快可减少产物中$\rm {{H}_{2}}O$的积累,减少反应 $\rm ($用化学方程式表示$\rm )$的发生,从而减少催化剂的失活,提高甲醇选择性。
${\\rm I}{{\\rm n}_{2}}{{\\rm O}_{3-x}}+x{{\\rm H}_{2}}{\\rm O}={\\rm I}{{\\rm n}_{2}}{{\\rm O}_{3}}+x\\rm {{H}_{2}}$
"]]已知催化剂活化:$\rm In_{2}O_{3}($无活性$)\overset{还原}{\underset{氧化}{\rightleftharpoons}}{\rm In}_{2}{\rm O}_{3-x}($有活性$\rm )$,流速加快可减少产物中$\rm H_{2}O$的积累,减少反应${\rm I}{{\rm n}_{2}}{{\rm O}_{3-x}}+x{{\rm H}_{2}}{\rm O}={\rm I}{{\rm n}_{2}}{{\rm O}_{3}}+x\rm {{H}_{2}}$的发生,减少催化剂的失活,提高甲醇选择性。
对于以上$\rm C{{O}_{2}}$制甲醇的过程,以下描述正确的是 $\rm ($填序号$\rm )$。
$\rm A$.反应中经历了$\rm In-C$、$\rm InO$键的形成和断裂
$\rm B$.加压可以提高$\rm C{{O}_{2}}$的平衡转化率
$\rm C$.升高温度可以提高甲醇在平衡时的选择性
$\\rm AB$
"]]$\rm A$.由图$\rm 1$可知,反应中经历了$\rm In-C$、$\rm In-O$键的形成和断裂,选项$\rm A$正确。
$\rm B$.$\rm CO_{2}$制甲醇是气体分子数减小的反应,加压平衡正向移动,可以提高$\rm CO_{2}$的平衡转化率,选项$\rm B$正确。
$\rm C$.由${\rm C{{O}_{2}}(g)+3{{H}_{2}}(g)=C{{H}_{3}}OH(g)+{{H}_{2}}O(g)}\quad\Delta H=-49.3\rm \ kJ/mol$是放热反应,升高温度平衡逆向移动,升高温”度会降低甲醇在平衡时的选择性,选项$\rm C$错误。
$\rm I$$\rm I$.一种以甲醇和二氧化碳为原料,利用${\rm Sn{{O}_{2}}}(m\rm Sn{{O}_{2}}/CC)$和$\rm CuO$纳米片$\rm (CuONS/CF)$作催化电极,电化学法制备甲酸$\rm ($甲酸盐$\rm )$的工作原理如图所示。
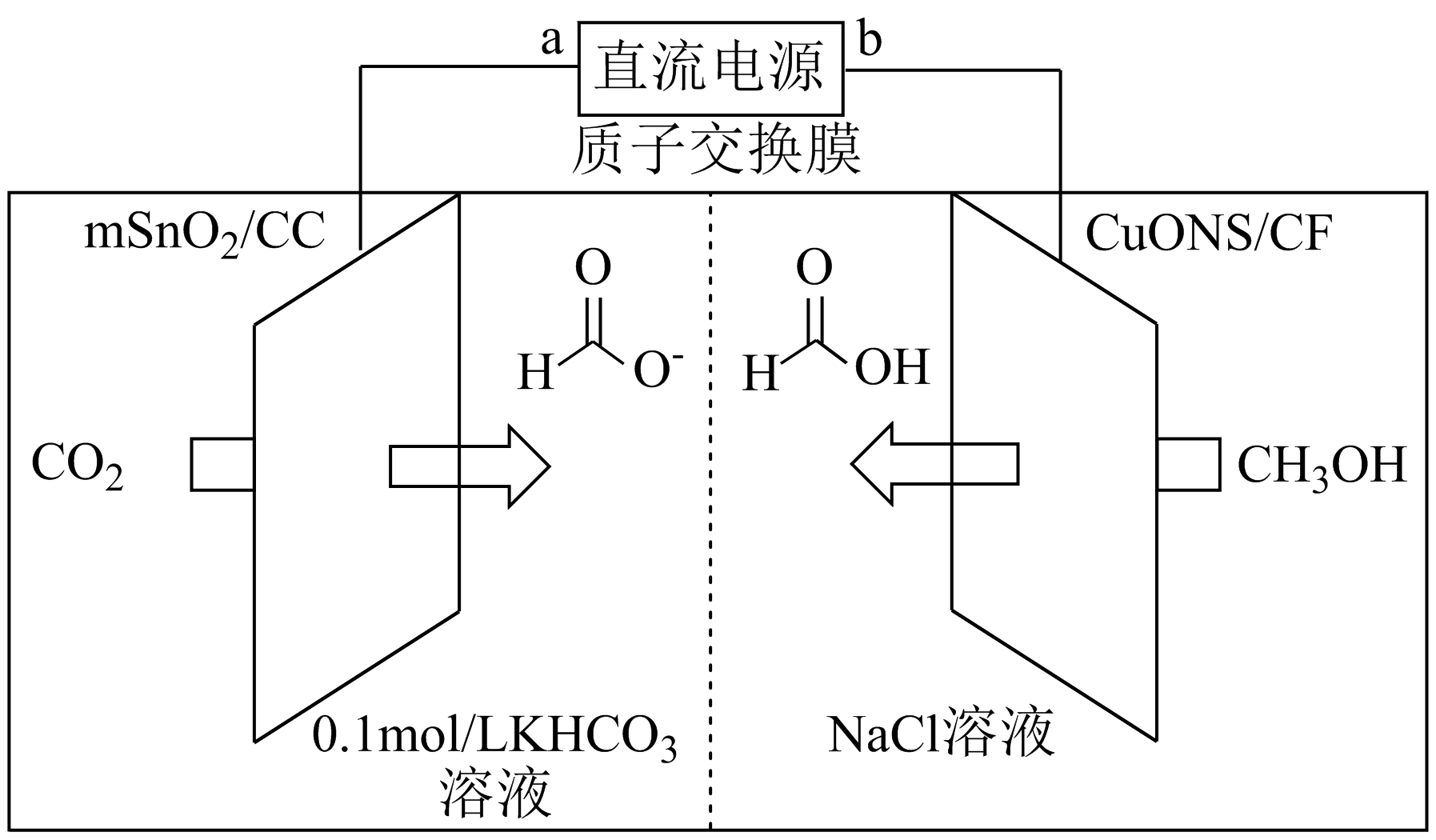
①阴极表面发生的电极反应式为 。
②若有$\rm 1\ mol\ {{H}^{+}}$通过质子交换膜,则理论上生成的$\rm HCO{{O}^{-}}$和$\rm HCOOH$共 $\rm \ mol$。
$\\rm 2C{{O}_{2}}+2{{e}^{-}}+{{H}_{2}}O=HCO{{O}^{-}}+HCO_{3}^{-}($或$\\rm C{{O}_{2}}+HCO_{3}^{-}+2{{e}^{-}}=HCO{{O}^{-}}+CO_{3}^{2-})$;$\\rm 0.75$
"]]①由图可知二氧化碳在左侧电极发生反应,其中碳元素化合价降低,则$\rm a$为负极,$\rm CO_{2}$得到电子生成$\rm HCOO^{-}$和$\rm HCO_{3}^{-}$或$\rm CO_{3}^{2-}$,该电极反应式为:$\rm 2C{{O}_{2}}+2{{e}^{-}}+{{H}_{2}}O=HCO{{O}^{-}}+HCO_{3}^{-}($或$\rm C{{O}_{2}}+HCO_{3}^{-}+2{{e}^{-}}=HCO{{O}^{-}}+CO_{3}^{2-})$。
②由第一问的分析可知$\rm b$为阳极,$\rm CH_{3}OH$失去电子生成$\rm HCOOH$,根据得失电子守恒和电荷守恒配平阳极反应为:$\rm CH_{3}OH-4e^{-}+H_{2}O=HCOOH+4H^{+}$,阴极电极反应为:$\rm 2C{{O}_{2}}+2{{e}^{-}}+{{H}_{2}}O=HCO{{O}^{-}}+HCO_{3}^{-}$,由此可以发现,若有$\rm 1\ mol\ H^{+}$通过质子交换膜时,则转移$\rm 1\ mol$电子,则此时该装置生成$\rm HCOO^{-}$和$\rm HCOOH$共计$\rm 0.75\ mol$。
电解部分甲醇后,将阴阳极的电解液混合,加入过量氢氧化钠后蒸干溶液,再向所得固体中加入过量稀硫酸,溶解后得$\rm 200\ mL$溶液。取$\rm 20\ mL$溶液,加入${{c}_{1}}\rm \ mol/L\ KMn{{O}_{4}}$溶液${{v}_{1}}\ \rm mL$,充分反应后,再加入过量$\rm KI$溶液和$\rm 5$滴淀粉溶液,用${{c}_{2}}\rm \ mol/L\ \rm N{{a}_{2}}{{S}_{2}}{{O}_{3}}$溶液滴定至终点,消耗$\rm N{{a}_{2}}{{S}_{2}}{{O}_{3}}$溶液体积为${{v}_{2}}\ \rm mL$。
已知:$\rm 5HCOOH+2Mn{{O}_{4}}+6{{H}^{+}}=5C{{O}_{2}}+2M{{n}^{2+}}+8{{H}_{2}}O$;$\rm 2{{S}_{2}}O_{3}^{2-}+{{I}_{2}}={{S}_{4}}O_{6}^{2-}+2{{I}^{-}}$。
①滴定终点的现象为 。
②假设电流效率为$\rm 100\%$,则电解池装置中通过的电子的物质的量为 $\rm \ mol$。
③若不加入氢氧化钠,直接蒸干溶液,则②中的计算结果将 $\rm ($填“偏高”、“偏低”或“不变”$\rm )$。
最后半滴$\\rm N{{a}_{2}}{{S}_{2}}{{O}_{3}}$溶液滴下时,溶液由蓝色变为无色,半分钟内不变蓝;$(5{{c}_{1}}{{v}_{1}}-{{c}_{2}}{{v}_{2}})/150$;偏低
"]]①向$\rm HCOOH$溶液中加入过量$\rm KMnO_{4}$溶液,发生反应:$\rm 5HCOOH+2Mn{{O}_{4}}+6{{H}^{+}}=5C{{O}_{2}}+2M{{n}^{2+}}+8{{H}_{2}}O$,再加入过量$\rm KI$溶液和$\rm 5$滴淀粉溶液,过量的$\rm KMnO_{4}$溶液将$\rm I^{-}$氧化为$\rm I_{2}$,离子方程式为:$\rm 16{{H}^{+}}+2MnO_{4}^{-}+10{{I}^{-}}=5{{I}_{2}}+2M{{n}^{2+}}+8{{H}_{2}}O$,此时溶液为蓝色的,然后加入$\rm N{{a}_{2}}{{S}_{2}}{{O}_{3}}$溶液滴定至终点,$\rm I_{2}$被还原为$\rm I^{-}$,溶液变无色,则滴定终点的现象为:最后半滴$\rm N{{a}_{2}}{{S}_{2}}{{O}_{3}}$溶液滴下时,溶液由蓝色变为无色,半分钟内不变蓝。
②由①分析可得关系式:$\rm 5HCOOH\sim 2KMnO_{4}\sim 5I_{2}\sim 10N{{a}_{2}}{{S}_{2}}{{O}_{3}}$,则与$\rm HCOOH$反应的$n{\rm (KMnO_{4})}={{c}_{1}}\ {\rm mol/L}\times {{v}_{1}}\times 1{{0}^{-3}}\ {\rm L}-\dfrac{{{c}_{2}}\ {\rm mol/L}\times {{v}_{2}}\times 1{{0}^{-3}}\ {\rm L}}{5}=\dfrac{(5{{c}_{1}}{{v}_{1}}-{{c}_{2}}{{v}_{2}})\times 1{{0}^{-3}}}{5}\ \rm mol$,则$n{\rm (HCOOH)}=2.5n{\rm (KMnO_{4})}=\dfrac{(5{{c}_{1}}{{v}_{1}}-{{c}_{2}}{{v}_{2}})\times 1{{0}^{-3}}}{5}\ {\rm mol}\times 2.5\times \dfrac{200}{20}=5(5{{c}_{1}}{{v}_{1}}-{{c}_{2}}{{v}_{2}})\times 1{{0}^{-3}}\ \rm mol$,由电极方程式$\rm 2C{{O}_{2}}+2{{e}^{-}}+{{H}_{2}}O=HCO{{O}^{-}}+HCO_{3}^{-}$、$\rm CH_{3}OH-4e^{-}+H_{2}O=HCOOH+4H^{+}$可知,消耗了$5(5{{c}_{1}}{{v}_{1}}-{{c}_{2}}{{v}_{2}})\times 1{{0}^{-3}}\ {\rm mol}\times \dfrac{4}{3}=\dfrac{20(5{{c}_{1}}{{v}_{1}}-{{c}_{2}}{{v}_{2}})}{3}\times 1{{0}^{-3}}\ \rm mol\ CO_{2}$,转移电子的物质的量为$\dfrac{20(5{{c}_{1}}{{v}_{1}}-{{c}_{2}}{{v}_{2}})}{3}\times 1{{0}^{-3}}\ {\rm mol}=\dfrac{5{{c}_{1}}{{v}_{1}}-{{c}_{2}}{{v}_{2}}}{150}\ \rm mol$。
③若不加入氢氧化钠,阳极产生的$\rm HCOOH$没有转化为$\rm HCOONa$,直接蒸干溶液,部分$\rm HCOOH$会挥发,导致②中的计算结果将偏低。
高中 | 化学平衡图像分析题目答案及解析(完整版)
