高中 | 盖斯定律 题目答案及解析
稿件来源:高途
高中 | 盖斯定律题目答案及解析如下,仅供参考!
选修四
第一章 化学反应与能量
第三节 化学反应热的计算
盖斯定律
近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:
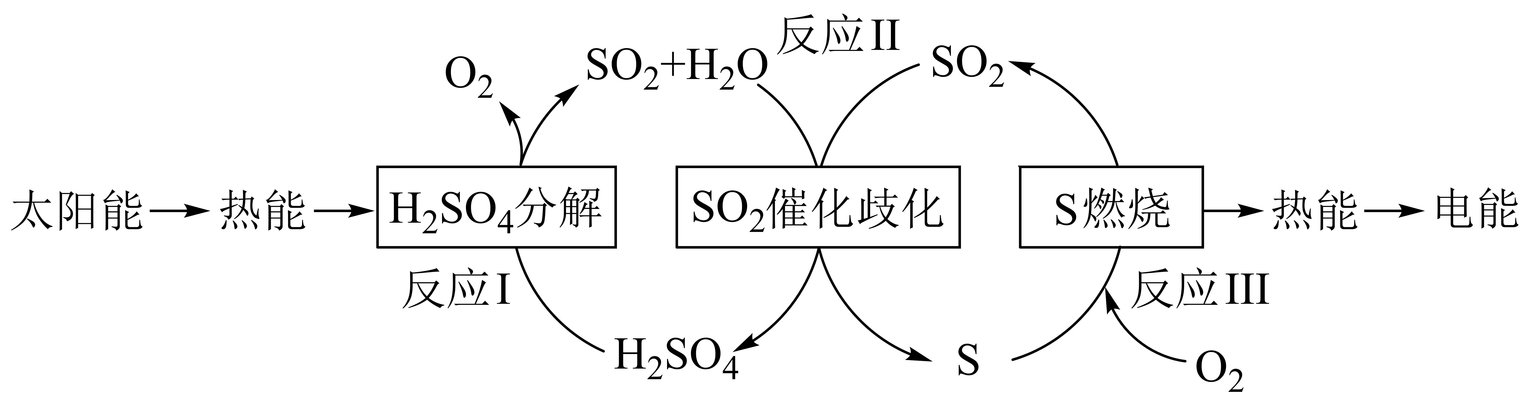
反应Ⅰ:$\text{2}{{\text{H}}_{\text{2}}}\text{S}{{\text{O}}_{\text{4}}}\left( \text{l} \right)\text{=2S}{{\text{O}}_{\text{2}}}\left( \text{g} \right)\text{+2}{{\text{H}}_{\text{2}}}\text{O}\left( \text{g} \right)+{{\text{O}}_{\text{2}}}\left( \text{g} \right)\quad \Delta {{H}_{1}}=+551\text{ kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$
反应Ⅲ:$\text{S}\left( \text{s} \right)+{{\text{O}}_{\text{2}}}\left( \text{g} \right)\text{=S}{{\text{O}}_{\text{2}}}\left( \text{g} \right)\quad \Delta {{H}_{3}}=-297\text{ kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$
反应Ⅱ的热化学方程式: 。
$\\text{3S}{{\\text{O}}_{\\text{2}}}\\left( \\text{g} \\right)\\text{+2}{{\\text{H}}_{\\text{2}}}\\text{O }\\left( \\text{g} \\right)\\text{=2}{{\\text{H}}_{\\text{2}}}\\text{S}{{\\text{O}}_{\\text{4}}}\\left( \\text{l} \\right)\\text{+S}\\left( \\text{s} \\right)\\quad \\Delta {{H}_{2}}=-254\\text{ kJ}\\cdot \\text{mo}{{\\text{l}}^{\\text{-1}}}$
"]]根据过程,反应$\rm II$为$\rm SO_{2}$催化歧化生成$\rm H_{2}SO_{4}$和$\rm S$,反应为$\rm 3SO_{2}+2H_{2}O=2H_{2}SO_{4}+S$。应用盖斯定律,反应$\rm I+$反应$\rm III$得,$\text{2}{{\text{H}}_{\text{2}}}\text{S}{{\text{O}}_{\text{4}}}\left( \text{l} \right)\text{+S}\left( \text{s} \right)=\text{3S}{{\text{O}}_{\text{2}}}\left( \text{g} \right)\text{+2}{{\text{H}}_{\text{2}}}\text{O}\left( \text{g} \right)\quad \Delta H=\Delta {{H}_{1}}+\Delta {{H}_{3}}=\left( +551\text{ kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}} \right)+\left( -297\text{ kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}} \right)=+254\text{ kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$,反应$\rm II$的热化学方程式为$\text{3S}{{\text{O}}_{\text{2}}}\left( \text{g} \right)\text{+2}{{\text{H}}_{\text{2}}}\text{O }\left( \text{g} \right)\text{=2}{{\text{H}}_{\text{2}}}\text{S}{{\text{O}}_{\text{4}}}\left( \text{l} \right)\text{+S}\left( \text{s} \right)\quad \Delta {{H}_{2}}=-254\text{ kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$。
对反应Ⅱ,在某一投料比时,两种压强下,$\rm H_{2}SO_{4}$在平衡体系中物质的量分数随温度的变化关系如图所示。
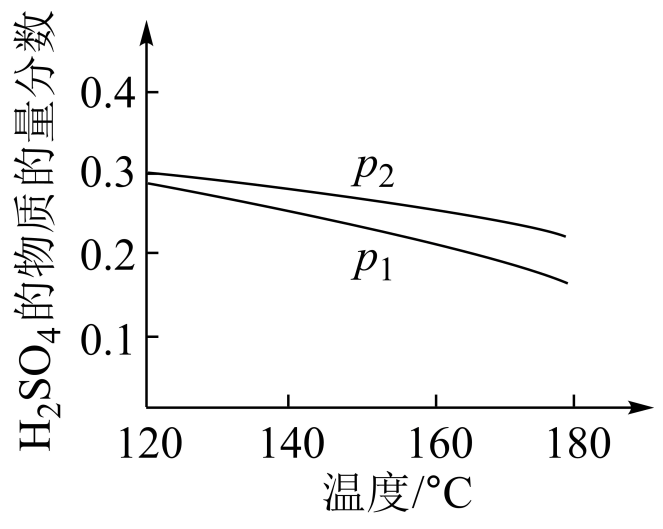
${{p}_{2}}$ ${{p}_{1}}\rm ($填“$\rm \gt $”或“$\rm \lt $”$\rm )$,得出该结论的理由是 。
$\\rm \\gt $; 反应Ⅱ是气体物质的量减小的反应,温度一定时,增大压强使反应正向移动,$\\rm H_{2}SO_{4}$ 的物质的量增大,体系总物质的量减小,$\\rm H_{2}SO_{4}$的物质的量分数增大
"]]在横坐标上任取一点,作纵坐标的平行线,可见温度相同时,${{p}_{2}}$时$\rm H_{2}SO_{4}$物质的量分数大于${{p}_{1}}$时;反应$\rm II$是气体分子数减小的反应,增大压强平衡向正反应方向移动,$\rm H_{2}SO_{4}$物质的量增加,体系总物质的量减小,$\rm H_{2}SO_{4}$物质的量分数增大;则${{p}_{2}}\gt {{p}_{1}}$。
$\rm I^{-}$可以作为水溶液中$\rm SO_{2}$歧化反应的催化剂,可能的催化过程如下。将$\rm ii$补充完整。
$\rm i$.$\rm SO_{2}+4I^{-}+4H^{+}=S↓+2I_{2}+2H_{2}O$
$\rm ii$.$\rm I_{2}+2H_{2}O+$ $\rm =$ $\rm +$ $\rm +2I^{-}$
$\\rm SO_{2}$ ; $\\text{SO}_{\\text{4}}^{\\text{2-}}$ ;$\\rm 4H^{+}$
"]]反应$\rm II$的总反应为$\rm 3SO_{2}+2H_{2}O=2H_{2}SO_{4}+S$,$\rm I^{-}$可以作为水溶液中$\rm SO_{2}$歧化反应的催化剂,催化剂在反应前后质量和化学性质不变,$\rm ($总反应$\rm -$反应$\rm i)\div \rm 2$得,反应$\rm ii$的离子方程式为$\rm I_{2}+2H_{2}O+SO_{2}=4H^{+}+SO_{4}^{2-}+2I^{-}$。
探究$\rm i$、$\rm ii$反应速率与$\rm SO_{2}$歧化反应速率的关系,实验如下:分别将$\rm 18$ $\rm mL$ $\rm SO_{2}$饱和溶液加入到$\rm 2$ $\rm mL$下列试剂中,密闭放置观察现象。$\rm ($已知:$\rm I_{2}$易溶解在$\rm KI$溶液中$\rm )$
| $\rm A$ | $\rm B$ | $\rm C$ | $\rm D$ | |
| 试剂组成 | $\rm 0.4$ $\rm mol·L^{-1}$ $\rm KI$ | $ a\text{ mol/L KI}$ $\rm0.2\text{ mol/L }{{\text{H}}_{\text{2}}}\text{S}{{\text{O}}_{\text{4}}}$ | $0.2\text{ mol/L }{{\text{H}}_{\text{2}}}\text{S}{{\text{O}}_{\text{4}}}$ | $0.2\text{ mol/L KI}$ $0.0002\text{ mol }{{\text{I}}_{\text{2}}}$ |
| 实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较$\rm A$快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较$\rm A$快 |
①$\rm B$是$\rm A$的对比实验,则$a=$ 。
②比较$\rm A$、$\rm B$、$\rm C$,可得出的结论是 。
③实验表明,$\rm SO_{2}$的歧化反应速率$\rm D\gt A$,结合$\rm i$、$\rm ii$反应速率解释原因: 。
$\\rm 0.4$ ; $\\rm I^{-}$是$\\rm SO_{2}$歧化反应的催化剂,$\\rm H^{+}$单独存在时不具有催化作用,但$\\rm H^{+}$可以加快歧化反应速率 ; 反应$\\rm ii$比$\\rm i$快;$\\rm D$中由反应$\\rm ii$产生的$\\rm H^{+}$使反应$\\rm i$加快
"]]①$\rm B$是$\rm A$的对比实验,采用控制变量法,$\rm B$比$\rm A$多加了$\rm 0.2$ $\rm mol/L$ $\rm H_{2}SO_{4}$,$\rm A$与$\rm B$中$\rm KI$浓度应相等,则$a=0.4$。
②对比$\rm A$与$\rm B$,加入$\rm H^{+}$可以加快$\rm SO_{2}$歧化反应的速率;对比$\rm B$与$\rm C$,单独$\rm H^{+}$不能催化$\rm SO_{2}$的歧化反应;比较$\rm A$、$\rm B$、$\rm C$,可得出的结论是:$\rm I^{- }$是$\rm SO_{2}$歧化反应的催化剂,$\rm H^{+}$单独存在时不具有催化作用,但$\rm H^{+}$可以加快歧化反应速率。
③对比$\rm D$和$\rm A$,$\rm D$中加入$\rm KI$的浓度小于$\rm A$,$\rm D$中多加了$\rm I_{2}$,反应$\rm i$消耗$\rm H^{+}$和$\rm I^{-}$,反应$\rm ii$中消耗$\rm I_{2}$,$\rm D$中“溶液由棕褐色很快褪色,变成黄色,出现浑浊较$\rm A$快”,反应速率$\rm D\gt \rm A$,由此可见,反应$\rm ii$比反应$\rm i$速率快,反应$\rm ii$产生$\rm H^{+}$使$c\left( {{\text{H}}^{+}} \right)$增大,从而反应$\rm i$加快。
高中 | 盖斯定律题目答案及解析(完整版)
