高中 | 盖斯定律 题目答案及解析
稿件来源:高途
高中 | 盖斯定律题目答案及解析如下,仅供参考!
选修四
第一章 化学反应与能量
第三节 化学反应热的计算
盖斯定律
碳氧化物、氮氧化物处理与利用是世界各国研究的热点问题。
消除汽车尾气中的$\text{NO}、\mathrm{}\text{CO}$,有利于减少$\text{PM2}\mathrm{}\text{5}$的排放。
已知:$\rm I$.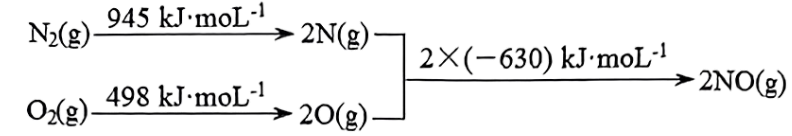
Ⅱ.${{\text{N}}_{\text{2}}}\text{(g)+}{{\text{O}}_{\text{2}}}\text{(g)}\rightleftharpoons \text{2NO(g)}\quad \Delta {{H}_{\text{1}}}$
$\text{2CO(g)+}{{\text{O}}_{\text{2}}}\text{(g)}\rightleftharpoons \text{2C}{{\text{O}}_{\text{2}}}\text{(g)}\quad \Delta {{H}_{\text{2}}}\text{=-565 kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$
①$\Delta {{H}_{\text{1}}}=$ 。
②在催化剂作用下$\text{NO}$和$\text{CO}$转化为无毒气体,写出反应的热化学方程式 。一定条件下,单位时间内不同温度下测定的氮氧化物转化率如下图所示。温度高于$\text{710 K}$时,随温度的升高氮氧化物转化率降低的原因可能是 。
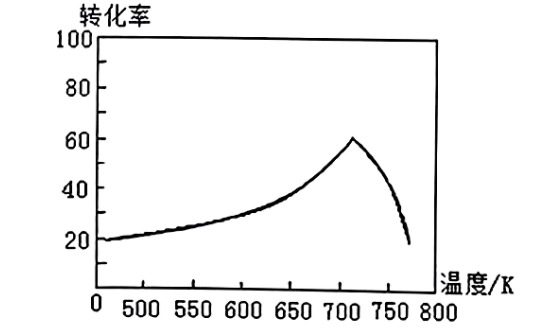
$+183\\text{ }\\rm kJ/mol$ ; $\\text{2NO(g)+2CO(g)}\\rightleftharpoons {{\\text{N}}_{\\text{2}}}\\text{(g)+2C}{{\\text{O}}_{\\text{2}}}\\quad \\Delta {{H}_{3}}=-748\\text{ kJ}\\cdot \\text{mo}{{\\text{l}}^{\\text{-1}}}$ 反应正向放热,升高温度平衡逆向移动,$\\rm NO$的转化率降低
"]]由图可知$\Delta {{H}_{\text{1}}}=\left( \text{945}+498-2\times 630 \right)\text{ kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}=+183\text{ kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$,①${{\text{N}}_{\text{2}}}\text{(g)+}{{\text{O}}_{\text{2}}}\text{(g)}\rightleftharpoons \text{2NO(g)}\quad \Delta {{H}_{\text{1}}}=+183\text{ kJ/mol}$、②$\text{2CO(g)+}{{\text{O}}_{\text{2}}}\text{(g)}\rightleftharpoons \text{2C}{{\text{O}}_{\text{2}}}\text{(g)}\quad \Delta {{H}_{\text{2}}}\text{=-565 kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$,目标反应为③$\text{2NO(g)+2CO(g)}\rightleftharpoons {{\text{N}}_{\text{2}}}\text{(g)+2C}{{\text{O}}_{\text{2}}}\quad \Delta {{H}_{3}}$,③$\rm =$②$\rm -$①,故$\Delta {{H}_{\text{1}}}\text{=-565 kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}-(+183\text{ kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}})=-748\text{ kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$;$\text{2NO(g)+2CO(g)}\rightleftharpoons {{\text{N}}_{\text{2}}}\text{(g)+2C}{{\text{O}}_{\text{2}}}\quad \Delta {{H}_{3}}=-748\text{ kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$,反应正向放热,升高温度平衡逆向移动,$\rm NO$的转化率降低;
消除燃煤烟气中的$\text{N}{{\text{O}}_{x}}\rm ($主要成分为$\text{NO}$、$\text{N}{{\text{O}}_{\text{2}}}$的混合物$\rm )$可以采用$\text{NaClO}$溶液吸收脱除。$\text{NaClO}$水解的离子方程式是 。
$\text{NaClO}$溶液吸收$\text{NO}$的主要过程如下:
$\rm i$.$\text{NO(aq)+HClO(aq)}\rightleftharpoons \text{N}{{\text{O}}_{\text{2}}}\text{(aq)+HCl(aq)}\quad \Delta {{H}_{\text{1}}}$,
ⅱ。$\text{3N}{{\text{O}}_{\text{2}}}\text{(aq)+}{{\text{H}}_{\text{2}}}\text{O(l)}\rightleftharpoons \text{2HN}{{\text{O}}_{\text{3}}}\text{(aq)+NO(aq)}\quad \Delta {{H}_{\text{2}}}$,
$\text{NO(aq)}$转化为$\text{HN}{{\text{O}}_{\text{3}}}\text{(aq)}$的热化学方程式是 。
研究$\text{pH}$对$\text{NO}$脱除率的影响。调节$\text{NaClO}$溶液的初始$\text{pH}$,$\text{NO}$的脱除率如下:
| 初始$\text{pH}$ | $\rm 3.5$ | $\rm 4.5$ | $\rm 5.5$ | $\rm 6.5$ | $\rm 7.5$ |
| $\text{NO}$脱除率 | $91\%$ | $\text{88 }\!\!\%$ | $\text{83 }\!\!\%$ | $\text{65 }\!\!\%$ | $\text{51 }\!\!\%$ |
$\text{pH}$影响$\text{NO}$脱除率的原因是 。
$\\text{Cl}{{\\text{O}}^{-}}+{{\\text{H}}_{\\text{2}}}\\text{O}\\rightleftharpoons \\text{HClO+OH}{}^{-}$ ; $\\text{2NO(aq)+3HClO(aq)+}{{\\text{H}}_{\\text{2}}}\\text{O(l)}\\rightleftharpoons 3\\text{HCl(aq)}+\\text{2HN}{{\\text{O}}_{\\text{3}}}\\text{(aq)}\\quad \\Delta H=3\\Delta {{H}_{\\text{1}}}+\\Delta {{H}_{\\text{2}}}$ ; $\\rm pH$减小,溶液中氢离子浓度增大,溶液中$\\text{HClO}\\rightleftharpoons \\text{Cl}{{\\text{O}}^{-}}+{{\\text{H}}^{+}}$平衡逆向移动,溶液中$\\rm HClO$的浓度增大引起$\\text{2NO(aq)+3HClO(aq)+}{{\\text{H}}_{\\text{2}}}\\text{O(l)}\\rightleftharpoons 3\\text{HCl(aq)}+\\text{2HN}{{\\text{O}}_{\\text{3}}}\\text{(aq)}$平衡正向移动,$\\rm NO$的脱除率增大。
"]]次氯酸根离子水解生成次氯酸和氢氧根离子,方程式为:$\text{Cl}{{\text{O}}^{-}}+{{\text{H}}_{\text{2}}}\text{O}\rightleftharpoons \text{HClO+OH}{}^{-}$;$\rm i$.$\text{NO(aq)+HClO(aq)}\rightleftharpoons \text{N}{{\text{O}}_{\text{2}}}\text{(aq)+HCl(aq)}\quad \Delta {{H}_{\text{1}}}$,ⅱ. $\text{3N}{{\text{O}}_{\text{2}}}\text{(aq)+}{{\text{H}}_{\text{2}}}\text{O(l)}\rightleftharpoons \text{2HN}{{\text{O}}_{\text{3}}}\text{(aq)+NO(aq)}\quad \Delta {{H}_{\text{2}}}$,目标反应为$\text{2NO(aq)+3HClO(aq)+}{{\text{H}}_{\text{2}}}\text{O(l)}\rightleftharpoons 3\text{HCl(aq)}+\text{2HN}{{\text{O}}_{\text{3}}}\text{(aq)}\quad \Delta H$,目标反应$\rm =3$ⅰ$\rm +$ⅱ,因此$\Delta H=3\Delta {{H}_{1}}+\Delta {{H}_{2}}$,$\text{NO(aq)}$转化为$\text{HN}{{\text{O}}_{\text{3}}}\text{(aq)}$的热化学方程式是$\text{2NO(aq)+3HClO(aq)+}{{\text{H}}_{\text{2}}}\text{O(l)}\rightleftharpoons 3\text{HCl(aq)}+\text{2HN}{{\text{O}}_{\text{3}}}\text{(aq)}\quad \Delta H=3\Delta {{H}_{\text{1}}}+\Delta {{H}_{\text{2}}}$;表中数据显示$\rm pH$越小,$\rm NO$的脱除率越大,这是因为$\rm pH$越小,溶液中氢离子浓度越大,溶液中$\text{HClO}\rightleftharpoons \text{Cl}{{\text{O}}^{-}}+{{\text{H}}^{+}}$平衡逆向移动,溶液中$\rm HClO$的浓度增大引起$\text{2NO(aq)+3HClO(aq)+}{{\text{H}}_{\text{2}}}\text{O(l)}\rightleftharpoons 3\text{HCl(aq)}+\text{2HN}{{\text{O}}_{\text{3}}}\text{(aq)}$平衡正向移动,$\rm NO$的脱除率增大。
高中 | 盖斯定律题目答案及解析(完整版)
