高中 | 盖斯定律 题目答案及解析
稿件来源:高途
高中 | 盖斯定律题目答案及解析如下,仅供参考!
选修四
第一章 化学反应与能量
第三节 化学反应热的计算
盖斯定律
以$\rm CO_{2}$、$\rm H_{2}$为原料合成$\rm CH_{3}OH$涉及的主要反应如下:
①$\text{C}{{\text{O}}_{\text{2}}}\left( \text{g} \right)\text{+3}{{\text{H}}_{\text{2}}}\left( \text{g} \right)\rightleftharpoons \text{C}{{\text{H}}_{\text{3}}}\text{OH}\left( \text{g} \right)+{{\text{H}}_{\text{2}}}\text{O}\left( \text{g} \right)\quad \Delta {{H}_{1}}=-49.5\text{ kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$
②$\text{CO}\left( \text{g} \right)\text{+2}{{\text{H}}_{\text{2}}}\left( \text{g} \right)\rightleftharpoons \text{C}{{\text{H}}_{\text{3}}}\text{OH}\left( \text{g} \right)\quad \Delta {{H}_{2}}=-90.4\text{ kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$
③$\text{C}{{\text{O}}_{\text{2}}}\left( \text{g} \right)+{{\text{H}}_{\text{2}}}\left( \text{g} \right)\rightleftharpoons \text{CO}\left( \text{g} \right)+{{\text{H}}_{\text{2}}}\text{O}\left( \text{g} \right)\quad \Delta {{H}_{3}}$
不同压强下,按照$n\left( \text{C}{{\text{O}}_{\text{2}}} \right):n\left( {{\text{H}}_{\text{2}}} \right)=1:3$投料,$\rm CO_{2}$平衡转化率随温度变化关系如图。下列说法正确的是$(\quad\ \ \ \ )$
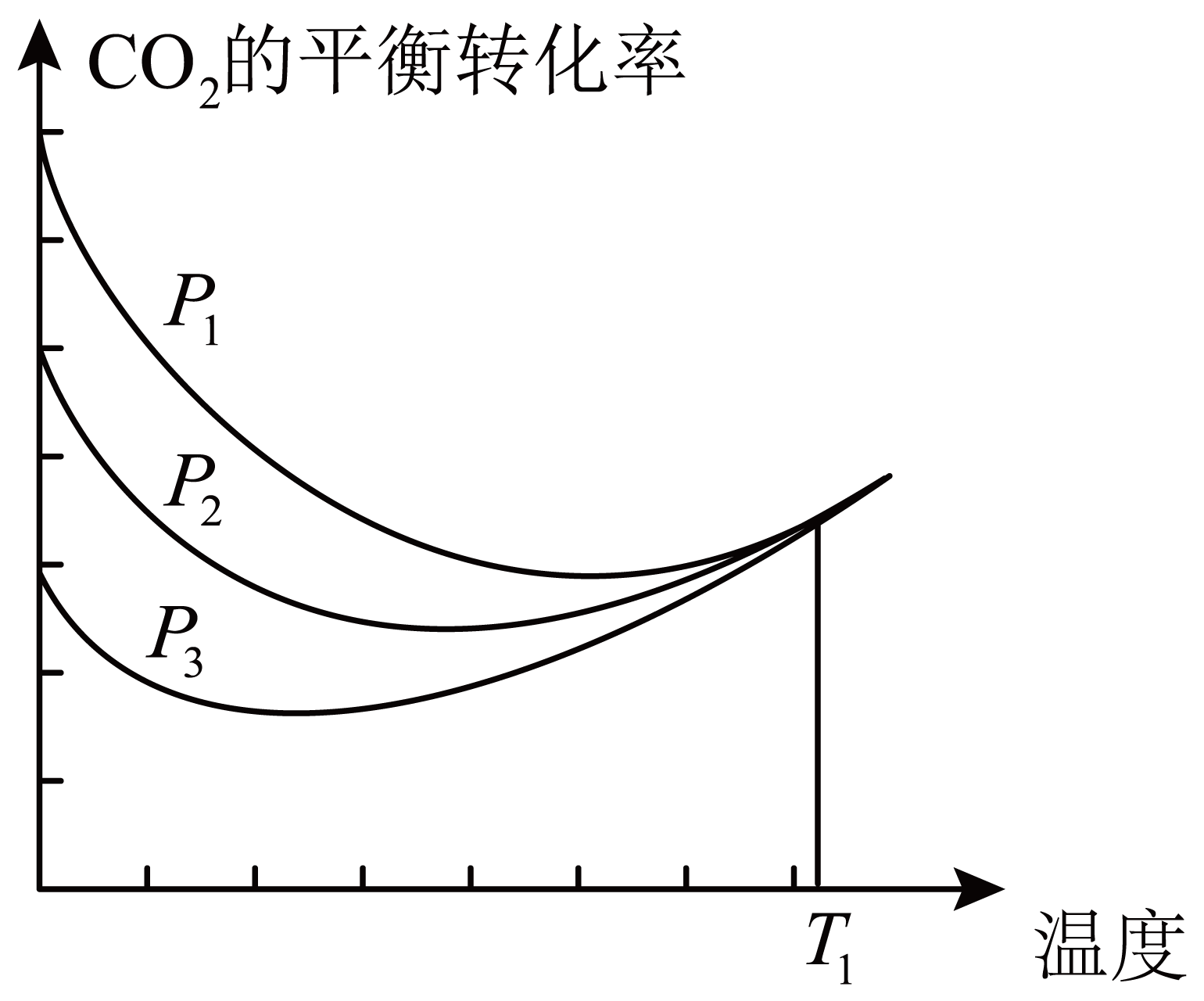
$\\Delta {{H}_{3}}=-40.9\\text{ kJ}\\cdot \\text{mo}{{\\text{l}}^{\\text{-1}}}$
","${{p}_{1}}\\lt \\text{ }{{p}_{2}}\\lt \\text{ }{{p}_{3}}$
","为同时提高$\\rm CO_{2}$的平衡转化率和$\\rm CH_{3}OH$的平衡产率,反应条件应选择高温、高压
","$\\rm T_{1}$温度时,三条曲线几乎交于一点的原因是:该温度下,主要发生反应③
"]$\rm A$.根据盖斯定律可知,反应③可由反应①$\rm -$反应②,故$\Delta {{H}_{3}}=\Delta {{H}_{1}}-\Delta {{H}_{2}}=\left( -49.5\text{ kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}} \right)-\left( -90.4\text{ kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}} \right)=+40.9\text{ kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$,$\rm A$错误;
$\rm B$.分析反应①正反应为气体体积减小的方向,反应③反应前后气体体积不变,故增大压强,反应①正向移动,$\rm CO_{2}$的转化率增大,反应③不移动,故${{p}_{1}}\gt {{p}_{2}}\gt {{p}_{3}}$,$\rm B$错误;
$\rm C$.为同时提高$\rm CO_{2}$的平衡转化率和$\rm CH_{3}OH$的平衡产率,即让反应①尽可能正向移动,而反应①是一个正反应为气体体积减小的放热反应,故反应条件应选择低温、高压,$\rm C$错误;
$\rm D$.根据$\rm A$的分析可知,反应③为吸热反应且反应前后气体的体积不变,故改变压强平衡不移动,升高温度平衡正向移动,故$ T_{1}$温度时,三条曲线几乎交于一点的原因是:该温度下,主要发生反应③,$\rm D$正确;
故选:$\rm D$
高中 | 盖斯定律题目答案及解析(完整版)
