高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
油气开采、石油化工、煤化工等行业的废气中均含有硫化氢,需要将其回收处理并加以利用。
Ⅰ$\rm .$高温热分解法:$2{{\text{H}}_{2}}\text{S}(\text{g})\rightleftharpoons {{\text{S}}_{2}}(\text{g})+2{{\text{H}}_{2}}(\text{g})\quad \Delta H=+170\text{ kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
有利于提高${{\text{H}}_{2}}\text{S}$平衡转化率的措施有 $\rm ($任写两种$\rm )$。
升温、减压
"]]该反应是熵增的吸热反应,升温、减压能使平衡向正反应方向移动,硫化氢的转化率增大;
升高温度,该反应的化学平衡常数 $\rm ($填“变大”“变小”或“不变”$\rm )$。
变大
"]]该反应是吸热反应,升高温度,平衡向正反应方向移动,平衡常数变大;
工业上,通常在等温、等压条件下将${{\text{H}}_{2}}\text{S}$与$\text{Ar}$的混合气体通入反应器,发生${{\text{H}}_{2}}\text{S}$热分解反应,达到平衡状态后,若继续向反应器中通入$\text{Ar},{{\text{H}}_{2}}\text{S}$的平衡转化率会 $\rm ($填“增大”“减小”或“不变”$\rm )$,利用平衡常数与浓度商的关系说明理由: 。
增大 ; 达到平衡状态后,若继续向反应器中通入$\\text{Ar}$,容器体积增大,各反应物和产物浓度减小相同的倍数,此时${{Q}_{\\text{c}}}=\\dfrac{{{c}^{2}}\\left( {{\\text{H}}_{2}} \\right)c\\left( {{\\text{S}}_{2}} \\right)}{{{c}^{2}}\\left( {{\\text{H}}_{2}}\\text{S} \\right)}\\lt K$,平衡正向移动
"]]达到平衡状态后,若继续向反应器中通入$\text{Ar}$,容器体积增大,各反应物和产物浓度减小相同的倍数,此时${{Q}_{\text{c}}}=\dfrac{{{c}^{2}}\left( {{\text{H}}_{2}} \right)c\left( {{\text{S}}_{2}} \right)}{{{c}^{2}}\left( {{\text{H}}_{2}}\text{S} \right)}\lt K$,平衡正向移动,硫化氢的转化率增大;
Ⅱ$\rm .$克劳斯法:硫化氢与氧气反应生成${{\text{S}}_{2}}(\text{g})$和水蒸气已知:$2{{\text{H}}_{2}}\text{S}(\text{g})+3{{\text{O}}_{2}}(\text{g})\rightleftharpoons 2\text{S}{{\text{O}}_{2}}(\text{g})+2{{\text{H}}_{2}}\text{O}(\text{g})\quad \Delta {{H}_{1}}=-1036\text{ kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
$4{{\text{H}}_{2}}\text{S}(\text{g})+2\text{S}{{\text{O}}_{2}}(\text{g})\rightleftharpoons 3{{\text{S}}_{2}}(\text{g})+4{{\text{H}}_{2}}\text{O}(\text{g})\quad \Delta {{H}_{2}}=+94\text{ kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
克劳斯法处理${{\text{H}}_{2}}\text{S}$的热化学方程式为 。
$2{{\\text{H}}_{2}}\\text{S}(\\text{g})+{{\\text{O}}_{2}}(\\text{g})\\rightleftharpoons {{\\text{S}}_{2}}(\\text{g})+2{{\\text{H}}_{2}}\\text{O}(\\text{g})\\quad \\Delta H=-314\\text{ kJ}/\\text{mol}$
"]]将已知反应依次编号为①②,由盖斯定律可知,$\rm ($反应①$\rm +$反应②$\rm )\times \dfrac{1}{3}$得到反应$\text{2}{{\text{H}}_{\text{2}}}\text{S(g)+}{{\text{O}}_{\text{2}}}\text{(g)}\rightleftharpoons {{\text{S}}_{\text{2}}}\text{(g)+2}{{\text{H}}_{\text{2}}}\text{O(g)}$,则反应$\Delta H=\left[ \left( -1036\text{ kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}} \right)+\text{ }\left( +94\text{ kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}} \right) \right]\times \dfrac{1}{3}\rm =-314$ $\rm kJ/mol$,反应的热化学方程式为$2{{\text{H}}_{2}}\text{S}(\text{g})+{{\text{O}}_{2}}(\text{g})\rightleftharpoons {{\text{S}}_{2}}(\text{g})+2{{\text{H}}_{2}}\text{O}(\text{g})\quad \Delta H=-314\text{ kJ}/\text{mol}$;
用克劳斯法处理${{\text{H}}_{2}}\text{S}$时,研究人员对反应条件对${{\text{S}}_{\text{2}}}$产率的影响进行了如下研究。
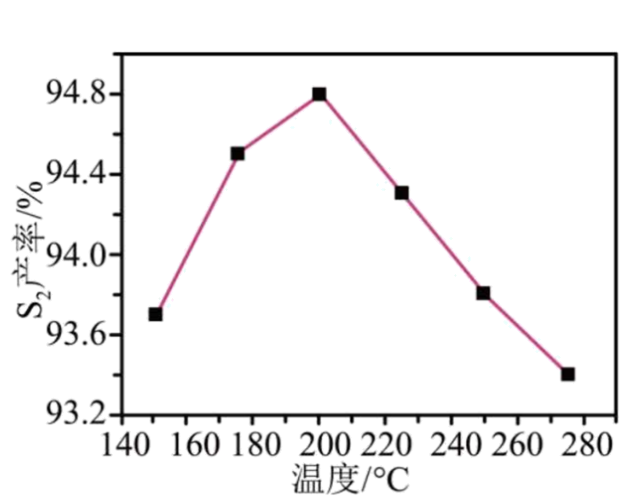
①其他条件相同时,相同时间内,${{\text{S}}_{\text{2}}}$产率随温度的变化如图所示。由图可见,随着温度升高,${{\text{S}}_{\text{2}}}$产率先增大后减小,原因是 。
②其他条件相同时,相同时间内,${{\text{S}}_{\text{2}}}$产率随$\dfrac{n\left( {{\text{O}}_{2}} \right)}{n\left( {{\text{H}}_{2}}\text{S} \right)}$值的变化如图所示,$\dfrac{n\left( {{\text{O}}_{2}} \right)}{n\left( {{\text{H}}_{2}}\text{S} \right)}$值过高不利于提高${{\text{S}}_{\text{2}}}$产率,可能的原因是 。
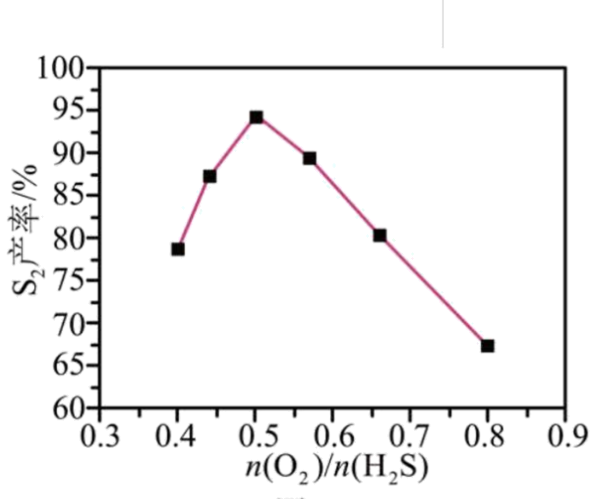
该反应是放热反应,反应未达到平衡时,升高温度,${{\\text{S}}_{2}}$的生成速率增大,单位时间${{\\text{S}}_{2}}$的生成量增大,转化率增大,当反应达到平衡时,升高温度,平衡逆向移动,${{\\text{S}}_{2}}$的转化率减小 ; ${{\\text{O}}_{2}}$浓度过高,${{\\text{H}}_{2}}\\text{S}$和${{\\text{O}}_{2}}$会反应生成$\\text{S}{{\\text{O}}_{2}}$,导致${{\\text{S}}_{2}}$产率减小
"]]①该反应是放热反应,反应未达到平衡时,升高温度,${{\text{S}}_{2}}$的生成速率增大,单位时间${{\text{S}}_{2}}$的生成量增大,转化率增大,当反应达到平衡时,升高温度,平衡逆向移动,${{\text{S}}_{2}}$的转化率减小;
②$\dfrac{n\left( {{\text{O}}_{2}} \right)}{n\left( {{\text{H}}_{2}}\text{S} \right)}$值过高不利于提高${{\text{S}}_{\text{2}}}$产率是因为${{\text{O}}_{2}}$浓度过高,${{\text{H}}_{2}}\text{S}$和${{\text{O}}_{2}}$会反应生成$\text{S}{{\text{O}}_{2}}$,导致${{\text{S}}_{2}}$产率减小。
高中 | 化学平衡常数题目答案及解析(完整版)
