高中 | 盖斯定律 题目答案及解析
稿件来源:高途
高中 | 盖斯定律题目答案及解析如下,仅供参考!
选修四
第一章 化学反应与能量
第三节 化学反应热的计算
盖斯定律
工业生产中产生的烟气中常含有氮氧化物$\text{N}{{\text{O}}_{ {x}}}$,为了防止污染大气,排放前需要经过适当处理脱除$\text{N}{{\text{O}}_{ {x}}}$。
在一定条件下,可用$\rm CO$还原$\rm NO$,其原理为:$2\text{CO}\left( \text{g} \right)+2\text{NO}\left( \text{g} \right)\rightleftharpoons 2\text{C}{{\text{O}}_{2}}\left( \text{g} \right)+{{\text{N}}_{2}}\left( \text{g} \right)$。
已知:标准摩尔生成焓指标准状态下由最稳定的单质合成$\rm 1$ $\rm mol$该物质的焓变。一些物质的燃烧热或标准摩尔生成焓如下表所示。
| 物质 | $\rm C(s)$ | $\rm CO(g)$ | $\rm NO(g)$ |
| 燃烧热$\Delta H\rm (kJ/mol)$ | $\rm -393.5$ | ||
| 标准摩尔生成焓${{\Delta}_{\text{f}}} {H}_{\text{m}}^{\theta }\rm (kJ/mol)$ | $\rm 0$ | $\rm -110.5$ | $\rm +90.5$ |
①$\text{2CO}\left( \text{g} \right)\text{+2NO}\left( \text{g} \right)\rightleftharpoons \text{2C}{{\text{O}}_{\text{2}}}\left( \text{g} \right)+{{\text{N}}_{\text{2}}}\left( \text{g} \right)\qquad\Delta H=$ 。
②下列措施能够同时提高上述反应的速率和$\rm NO$平衡转化率的是 $\rm ($填标号$\rm )$。
$\rm A$.使用催化剂 $\rm B$.及时分离生成的$\rm \text{C}{{\text{O}}_{\text{2}}}$ $\rm C$.升高温度 $\rm D$.提高$\rm CO$的浓度
③一定温度下,在体积恒为$\rm 2\;\rm L$的密闭容器中通入$\rm CO$与$\rm NO$各$\rm 2$ $\rm mol$,初始压强为$\rm 20$ $\rm kPa$。仅发生上述反应,达到平衡后,$ {c}\left( \text{NO} \right) :c \left( {{\text{N}}_{\text{2}}} \right) =2:1 $,则此温度下该反应的压强平衡常数${{ {K}}_{\text{p}}}=$ $\text{kP}{{\text{a}}^{-1}}$。再向容器中通入$\rm 2$ $\rm mol$ $\text{C}{{\text{O}}_{\text{2}}}$和$\rm 1$ $\rm mol$ ${{\text{N}}_{\text{2}}}$,达到新的平衡时,混合气体中$\rm NO$的体积分数相比原平衡 $\rm ($选填“增大”、“减小”或“不变”$\rm )$。
$-747\\text{ kJ/mol}$;$\\rm D$;$\\rm 0.1$;减小
"]]①由表中数据得热化学方程式:$\text{I C}\left( \text{s} \right)+{{\text{O}}_{\text{2}}}\text{(g)=C}{{\text{O}}_{\text{2}}}\text{(g)}\qquad\Delta{{H}_{1}}=-393.5\text{ kJ/mol}$
$\text{II C}\left( \text{g} \right)+\dfrac{1}{2}{{\text{O}}_{\text{2}}}\text{(g)=CO(g)}\qquad\Delta{{H}_{2}}=-110.5\text{ kJ/mol}$
$\text{III}\dfrac{1}{2}{{\text{N}}_{2}}\left( \text{g} \right)+\dfrac{1}{2}{{\text{O}}_{\text{2}}}\text{(g)=NO(g)}\qquad\Delta{{H}_{3}}=+90.5\text{ kJ/mol}$
由该盖斯定律可知反应$\text{2CO}\left( \text{g} \right)\text{+2NO}\left( \text{g} \right)\rightleftharpoons \text{2C}{{\text{O}}_{\text{2}}}\left( \text{g} \right)+{{\text{N}}_{\text{2}}}\left( \text{g} \right)$可由$\rm -2\times III-2\times II+2\times I$得到,则$\Delta H=\rm -2\times (+90.5\text{ kJ/mol}\rm )-2\times (-110.5\text{ kJ/mol}\rm )+2\times (-393.5\text{ kJ/mol}\rm )=-747\text{ kJ/mol}$。
②$\rm A$.使用催化剂只能加快反应速率,对化学平衡无影响,故$\rm A$不选;
$\rm B$.及时分离生成的$\rm \text{C}{{\text{O}}_{\text{2}}}$,有利于平衡正向移动,从而提高$\rm NO$的转化率,但降低浓度反应速率减小,故$\rm B$不选;
$\rm C$.该反应为放热反应,升高温度平衡逆向移动,降低了$\rm NO$的转化率,故$\rm C$不选;
$\rm D$.提高$\rm CO$的浓度,加快反应速率,同时使平衡正向移动,提高$\rm NO$转化率,故$\rm D$选;
故答案为:$\rm D$;
③结合已知信息列三段式得:
$\begin{matrix} {} & \text{2CO}\left( \text{g} \right) & \text{+2NO}\left( \text{g} \right) & \rightleftharpoons & \text{2C}{{\text{O}}_{\text{2}}}\left( \text{g} \right) & +{{\text{N}}_{\text{2}}}\left( \text{g} \right) \\起始 (\text{mol}) & 2 & 2 & {} & 0 & 0 \\ 转化(\text{mol}) & {x} & {x} & {} & {x} & 0.5{x} \\平衡 (\text{mol}) & 2-{x} & 2-{x} & {} & {x} & 0.5{x} \\ \end{matrix}$
已知平衡时:$ {c}\left( \text{NO} \right):c\left( {{\text{N}}_{\text{2}}} \right)\text{=2:1}$,即$(2-x):0.5x=2:1$,$x=1$,则平衡时:$n\rm (CO)=1\;\rm mol$,$n\rm (NO)=1\;\rm mol$,$n\rm (CO_{2})=1\;\rm mol$,$n(N_{2})=0.5\;\rm mol$,平衡时总气体物质的量为$\rm 3.5\;\rm mol$;根据压强比等于气体物质的量之比可得:$\dfrac{{{{p}}_总{}}}{{{{p}}_初{}}}=\dfrac{3.5}{4}$,${{{p}}_总{}}\rm =17.5\;\rm kPa$,${{ {K}}_{\rm{p}}}=\dfrac{ {p(}{{\text{N}}_{2}}\text{)}\cdot {{{p}}^{2}}\text{(C}{{\text{O}}_{2}}\text{)}}{{{{p}}^{2}}\text{(CO)}\cdot {{{p}}^{2}}\text{(NO)}}=\dfrac{{{(\dfrac{1}{3.5}{{{p}}_总{}})}^{2}}\dfrac{0.5}{3.5}{{{p}}_总{}}}{{{(\dfrac{1}{3.5}{{{p}}_总{}})}^{2}}{{(\dfrac{1}{3.5}{{{p}}_总{}})}^{2}}}\rm =0.1\text{ kP}{{\text{a}}^{-1}}$;
同时求得该反应的平衡常数$ K=\dfrac{\dfrac{0.5}{2}\times {{(\dfrac{1}{2})}^{2}}}{{{(\dfrac{1}{2})}^{2}}\times {{(\dfrac{1}{2})}^{2}}}=1$,再向容器中通入$\rm 2$ $\rm mol$ $\text{C}{{\text{O}}_{\text{2}}}$和$\rm 1$ $\rm mol$ ${{\text{N}}_{\text{2}}}$,相当于在平衡后又充入$\rm 2\;\rm mol\;\rm CO$和$\rm 2\;\rm mol\;\rm NO$,即与原平衡等效,体积不变,相当于增大压强,平衡正向移动,故$\rm NO$体积分数减小。
$\rm CO$也可以还原$\text{N}{{\text{O}}_{2}}$,反应原理为:$\text{N}{{\text{O}}_{2}}\left( \text{g} \right)+\text{CO}\left( \text{g} \right)=\text{NO}\left( \text{g} \right)+\text{C}{{\text{O}}_{2}}\left( \text{g} \right)$。
研究发现,该反应分两步进行:
第一步:$\text{N}{{\text{O}}_{\text{2}}}\left( \text{g} \right)\text{+N}{{\text{O}}_{\text{2}}}\left( \text{g} \right)\to \text{N}{{\text{O}}_{\text{3}}}\left( \text{g} \right)\text{+NO}\left( \text{g} \right)\rm ($慢反应$\rm )$
第二步:$\text{N}{{\text{O}}_{\text{3}}}\left( \text{g} \right)\text{+CO}\left( \text{g} \right)\to \text{N}{{\text{O}}_{\text{2}}}\left( \text{g} \right)\text{+C}{{\text{O}}_{\text{2}}}\left( \text{g} \right)\rm ($快反应$\rm )$
已知:此条件下,该反应的化学反应速率$ {v=k}\cdot {c}\left( \text{N}{{\text{O}}_{\text{2}}} \right) (k$为速率常数,只与温度有关$\rm )$。下列分析正确的是$(\quad\ \ \ \ )\rm ($填标号$\rm )$。
增大$\\text{N}{{\\text{O}}_{2}}$浓度,该反应速率增大
","增大$\\rm CO$浓度,该反应速率几乎不变
","$\\text{N}{{\\text{O}}_{3}}$是该反应的催化剂
","第一步反应的活化能小于第二步反应
"]$\rm A\rm .$反应分两步进行,反应速率主要取决于慢反应,所以$\text{N}{{\text{O}}_{2}}$浓度对反应速率得影响较大,增大$\text{N}{{\text{O}}_{2}}$浓度,该反应速率增大,故$\rm A$正确;
$\rm B\rm .$此条件下,该反应的化学反应速率$ {v=k}\cdot {c}\left( \text{N}{{\text{O}}_{\text{2}}} \right)$,与$\rm CO$浓度无关,增大$\rm CO$浓度,该反应速率几乎不变,故$\rm B$正确;
$\rm C\rm .$反应物和最终产物中都没有$\text{N}{{\text{O}}_{3}}$,$\text{N}{{\text{O}}_{3}}$是该反应的催化剂,故$\rm C$错误;
$\rm D\rm .$因第二步反应是快反应,所以第二步反应的活化能较小,故$\rm D$错误;
故答案为:$\rm AB$;
工业烟气中的$\text{N}{{\text{O}}_{2}}$常常无法完全脱除,可用下图所示装置来测定工业烟气中$\text{N}{{\text{O}}_{2}}$的脱除率,其原理如下:
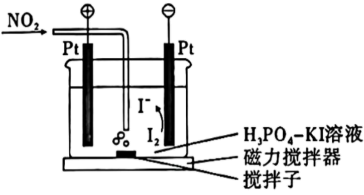
测定开始前,电解质溶液中$\dfrac{ {c}\left( {{\text{I}}_{\text{2}}} \right)}{ {c}\left( {{\text{I}}^{-}} \right)} {=n}$。测定时,将含$\text{N}{{\text{O}}_{\text{2}}}$的烟气中通入电解质溶液中使$\text{N}{{\text{O}}_{\text{2}}}$与${{\text{I}}^{-}}$反应$\text{N}{{\text{O}}_{\text{2}}}$被还原为$\rm NO$,烟气中其他成分均不参与反应$\rm )$。此时电解池自动开始工作,直到$\dfrac{ {c}\left( {{\text{I}}_{\text{2}}} \right)}{ {c}\left( {{\text{I}}^{-}} \right)}$重新变为$n$,电解自动结束。
①装置工作时,阴极反应的电极反应式为: ,$\text{N}{{\text{O}}_{\text{2}}}$被$\mathrm{I}^{-}$还原的离子方程式为 。
②将某工业烟气分为等体积的两份,其中一份直接通入该装置,另一份脱除部分$\text{N}{{\text{O}}_{\text{2}}}$后再通入该装置,两次电解过程中转移的电子量分别为$a$ $\rm mol$、$b$ $\rm mol$,则本次$\text{N}{{\text{O}}_{\text{2}}}$脱除率为 。
${{\\text{I}}_{\\text{2}}}\\text{+2}{{\\text{e}}^{-}}\\text{=2}{{\\text{I}}^{-}}$;$\\text{N}{{\\text{O}}_{2}}\\text{+2}{{\\text{I}}^{-}}\\text{+2}{{\\text{H}}_{3}}\\text{P}{{\\text{O}}_{4}}\\text{=NO+}{{\\text{I}}_{\\text{2}}}\\text{+2}{{\\text{H}}_{2}}\\text{PO}_{4}^{-}+{{\\text{H}}_{\\text{2}}}\\text{O}$;$\\dfrac{ {a-b}}{ {a}}\\times 100\\%$
"]]①装置工作时,阴极碘单质得电子被还原成$\rm I^{-}$,电极反应式为:${{\text{I}}_{\text{2}}}\text{+2}{{\text{e}}^{-}}\text{=2}{{\text{I}}^{-}}$,$\text{N}{{\text{O}}_{2}}$在电解池中被还原为$\rm NO$,$\rm 1\;\rm mol\text{ N}{{\text{O}}_{2}}$得$\rm 2\;\rm mol$电子,$\rm 2\;\rm mol\;\rm I^{-}$失$\rm 2\;\rm mol$电子生成$\rm 1\;\rm mol{{\text{ I}}_{\text{2}}}$,结合电解质环境${{\text{H}}_{3}}\text{P}{{\text{O}}_{4}}$提供氢离子最终生成${{\text{H}}_{2}}\text{PO}_{4}^{-}$,根据得失电子守恒,电荷守恒及原子守恒,得离子方程式:$\text{N}{{\text{O}}_{2}}\text{+2}{{\text{I}}^{-}}\text{+2}{{\text{H}}_{3}}\text{P}{{\text{O}}_{4}}\text{=NO+}{{\text{I}}_{\text{2}}}\text{+2}{{\text{H}}_{2}}\text{PO}_{4}^{-}+{{\text{H}}_{\text{2}}}\text{O}$;
②可用转移电子得物质的量表示$\text{N}{{\text{O}}_{2}}$的物质的量,则脱除前$\text{N}{{\text{O}}_{2}}$的物质的量为$a\;\rm mol$,则脱除后$\text{N}{{\text{O}}_{2}}$的物质的量为$b\;\rm mol$,$\text{N}{{\text{O}}_{2}}$的脱出率为:$\dfrac{ {a-b}}{ {a}}\times 100\%$。
高中 | 盖斯定律题目答案及解析(完整版)
