高中 | 化学平衡图像分析 题目答案及解析
稿件来源:高途
高中 | 化学平衡图像分析题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡图像分析
黄铁矿$\rm [$主要成分为二硫化亚铁$\rm (FeS_{2})]$、焦炭和适量空气混合加热发生如下反应:
$\rm i$.$3\text{Fe}{{\text{S}}_{2}}+2\text{C}+3{{\text{O}}_{2}}\begin{matrix} \underline{\underline{\triangle }} \\ {} \\ \end{matrix}3{{\text{S}}_{2}}+\text{F}{{\text{e}}_{3}}{{\text{O}}_{4}}+2\text{CO}$
反应$\rm i$生成$\rm 1\;\rm mol\;\rm S_{2}$时,转移电子的物质的量为 $\rm \;\rm mol$。
$\\rm 4$
"]]$3\text{Fe}{{\text{S}}_{2}}+2\text{C}+3{{\text{O}}_{2}}\begin{matrix} \underline{\underline{\triangle }} \\ {} \\ \end{matrix}3{{\text{S}}_{2}}+\text{F}{{\text{e}}_{3}}{{\text{O}}_{4}}+2\text{CO}$反应中,碳元素从$\rm 0$价升高到$\rm +2$价、铁元素化合价升高,$\rm 3$个铁原子共升高$\rm 2$价、硫元素从$\rm -1$价降低到$\rm 0$价,氧元素从$\rm 0$价降低到$\rm -2$价,每当生成$\rm 3\;\rm mol\;\rm S_{2}$,理论上转移$\rm 12\;\rm mol$电子,则反应$\rm i$生成$\rm 1\;\rm mol\;\rm S_{2}$时,转移电子的物质的量为$\rm 4\;\rm mol$。
反应$\rm i$所得气体经冷凝回收$\rm S_{2}$后,尾气中还含有$\rm CO$和$\rm SO_{2.}$将尾气通过催化剂进行处理,发生反应$\rm ii$,同时发生副反应$\rm iii$。
$\rm ii$.$2\text{S}{{\text{O}}_{2}}\left( \text{g} \right)+4\text{CO}\left( \text{g} \right)\rightleftharpoons {{\text{S}}_{2}}\left( \text{g} \right)+4\text{C}{{\text{O}}_{2}}\left( \text{g} \right) \quad \Delta H\lt 0$
$\rm iii$.$\text{S}{{\text{O}}_{2}}\left( \text{g} \right)+3\text{CO}\left( \text{g} \right)\rightleftharpoons \text{COS}\left( \text{g} \right)+2\text{C}{{\text{O}}_{2}}\left( \text{g} \right)\quad \Delta H\lt 0$
理论分析及实验结果表明,$\rm 600$~$\rm 1000K$范围内,$\rm SO_{2}$平衡转化率接近$\rm 100\%$。其他条件相同,不同温度下,$\rm S_{2}$、$\rm COS$平衡产率和$\rm 10\;\rm min$时$\rm S_{2}$实际产率如图。
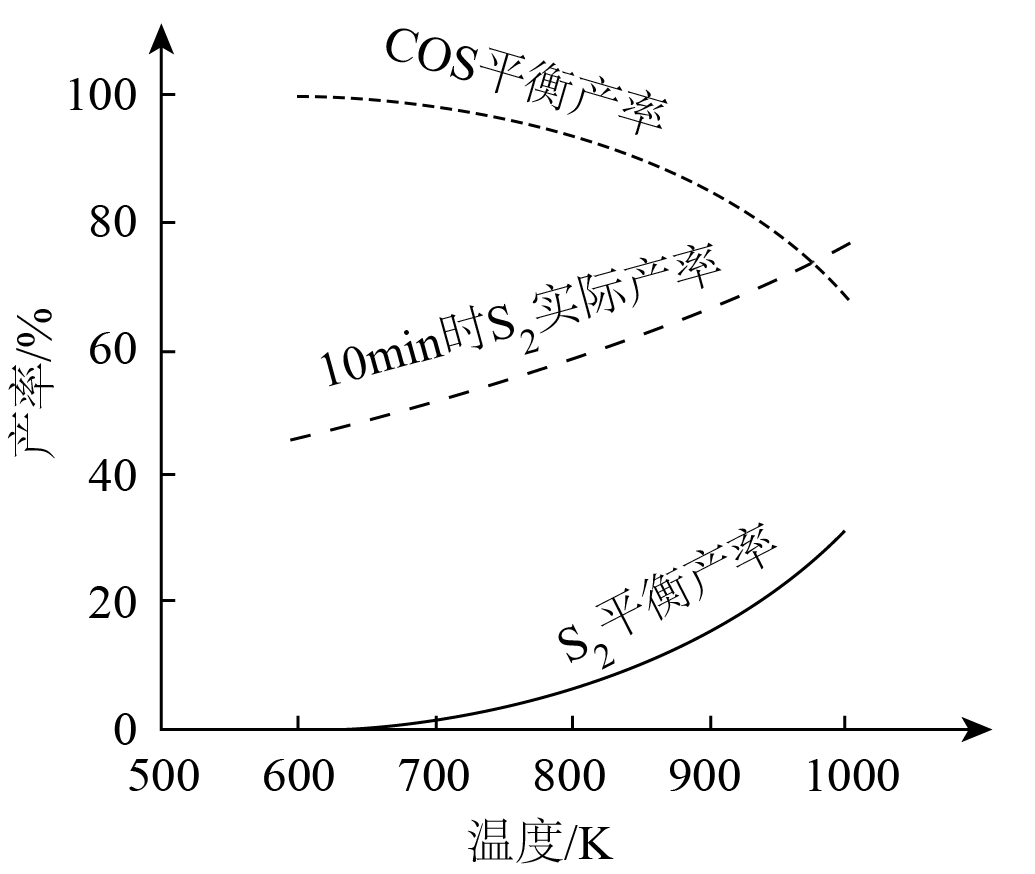
①比较反应速率:反应$\rm ii$ 反应$\rm iii($填“大于”或“小于”$\rm )$。
②随温度升高,$\rm S_{2}$平衡产率上升,推测其原因是 。
③$\rm 900\ K$,在$\rm 10\;\rm min$后继续反应足够长时间,推测$\rm S_{2}$实际产率的变化趋势可能为 。
大于; 温度升高,反应$\\rm iii$平衡逆向移动,使$ c(\\rm SO_{2})$、$\\rm c(CO)$增大;对于反应$\\rm ii$,浓度改变对平衡的影响超过温度改变的影响,平衡正向移动 ;先增大后减小至$\\rm 900\\ K$时$\\rm S_{2}$的平衡产率后保持不变或:减小至$\\rm 900\\ K$时$\\rm S_{2}$的平衡产率后保持不变
"]]①发生的反应有$\rm ii$.$2\text{S}{{\text{O}}_{2}}\left( \text{g} \right)+4\text{CO}\left( \text{g} \right)\rightleftharpoons {{\text{S}}_{2}}\left( \text{g} \right)+4\text{C}{{\text{O}}_{2}}\left( \text{g} \right)\quad \Delta H\lt 0$
$\rm iii$.$\text{S}{{\text{O}}_{2}}\left( \text{g} \right)+3\text{CO}\left( \text{g} \right)\rightleftharpoons \text{COS}\left( \text{g} \right)+2\text{C}{{\text{O}}_{2}}\left( \text{g} \right)\quad \Delta H\lt 0$,已知$\rm 600$~$\rm 1000\ K$范围内,$\rm SO_{2}$平衡转化率接近$\rm 100\%$,由图可知$\rm 10\;\rm min$时$\rm S_{2}$实际产率从略低于$\rm 50\%$到$\rm 70\%$左右,温度越高反应速率越快且越不利于正反应,可见温度高速度快决定了$\rm 10\;\rm min$时含硫产物以$\rm S_{2}$为主,说明反应速率:反应$\rm ii$大于反应$\rm iii$。
②发生反应$\rm ii$,同时发生副反应$\rm iii$。二者均为放热反应,升温平衡左移,则随温度升高,$\rm S_{2}$平衡产率上升的可能原因是:温度升高,反应$\rm iii$平衡逆向移动,使$ c(\rm SO_{2})$、$ c(\rm CO)$增大,对于反应$\rm ii$,浓度改变对平衡的影响超过温度改变的影响,平衡正向移动。
③通过观察图像可知,$\rm 10\;\rm min$时$\rm S_{2}$的实际产率大于平衡产率,所以最终要减小到与$\rm 900\ K$时产率相等,则$\rm 900\ K$,在$\rm 10\;\rm min$后继续反应足够长时间,$\rm S_{2}$实际产率的变化趋势可能为:先增大后减小至$\rm 900\ K$时$\rm S_{2}$的平衡产率后保持不变,或:减小至$\rm 900\ K$时$\rm S_{2}$的平衡产率后保持不变。
处理后的尾气仍含少量$\rm SO_{2}$,经$\rm Na_{2}CO_{3}$溶液洗脱处理后,所得洗脱液主要成分为$\rm Na_{2}CO_{3}$、$\rm NaHCO_{3}$和$\rm Na_{2}SO_{3.}$利用生物电池技术,可将洗脱液中的$\rm Na_{2}SO_{3}$转化为单质硫$\rm ($以$\rm S$表示$\rm )$回收。
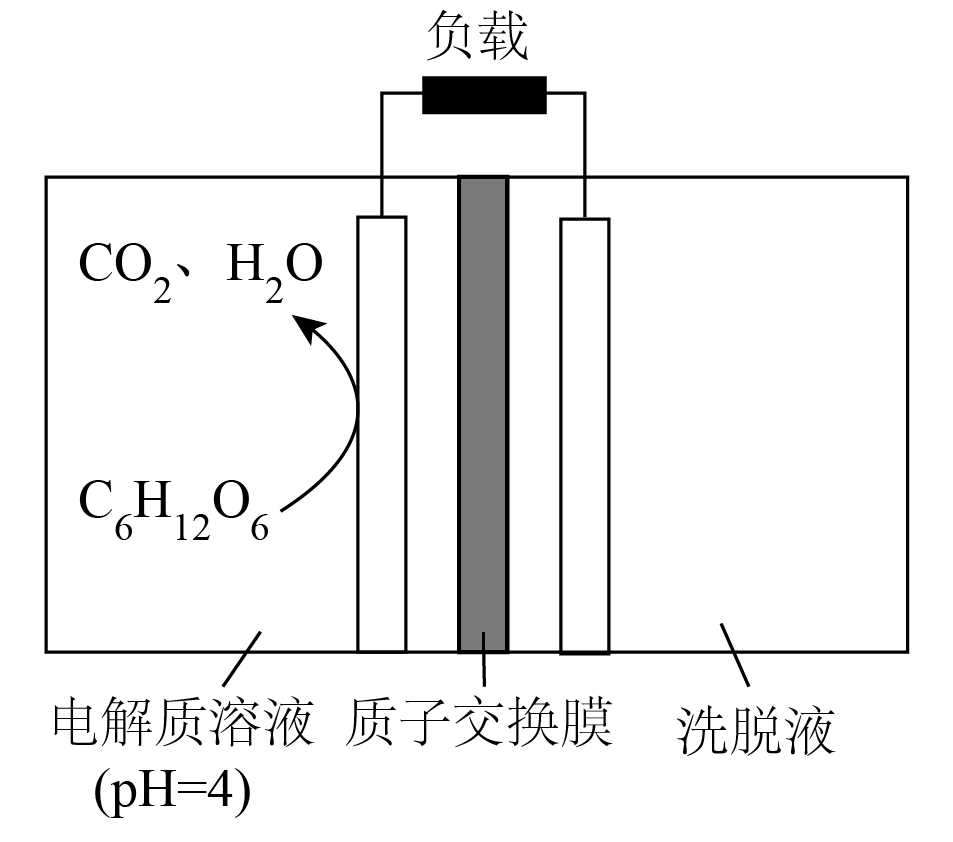
①该装置中,正极的电极反应式为 。
②一段时间后,若洗脱液中$\text{SO}_{3}^{2-}$的物质的量减小了$\rm 1\;\rm mol$,则理论上$\text{HCO}_{3}^{-}$减小了 $\rm \;\rm mol$。
$\\text{SO}_{\\text{3}}^{\\text{2-}}\\text{+4}{{\\text{e}}^{-}}\\text{+6HCO}_{\\text{3}}^{-}\\text{=S}\\downarrow \\text{+3}{{\\text{H}}_{\\text{2}}}\\text{O+6CO}_{3}^{2-}$; $\\rm 2$
"]]①据分析,该装置中,正极的电极反应式为$\text{SO}_{\text{3}}^{\text{2-}}\text{+4}{{\text{e}}^{-}}\text{+6HCO}_{\text{3}}^{-}\text{=S}\downarrow \text{+3}{{\text{H}}_{\text{2}}}\text{O+6CO}_{3}^{2-}$。
②根据电极方程式可知,当消耗$\rm 1\;\rm mol$亚硫酸根离子,转移$\rm 4\;\rm mol$电子,同时消耗$\rm 6\;\rm mol$碳酸氢根离子,生成$\rm 6\;\rm mol$碳酸根离子,根据电荷守恒,则有$\rm 4\;\rm mol$的$\rm H^{+}$通过质子交换膜来到正极,$\rm 4\;\rm mol$氢离子可以结合$\rm 4\;\rm mol$的碳酸根离子生成$\rm 4\;\rm mol$的碳酸氢根离子,则理论上碳酸氢根离子减小了$\rm 2\;\rm mol$。
高中 | 化学平衡图像分析题目答案及解析(完整版)
