| 导电的原因及条件 题目答案及解析
稿件来源:高途
| 导电的原因及条件题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第二节 离子反应
导电的原因及条件
使用如图装置$\rm ($搅拌装置略$\rm )$探究溶液离子浓度变化,灯光变化不可能出现“亮$\rm →$灭$\rm →$亮”现象的是$\rm (\qquad)$
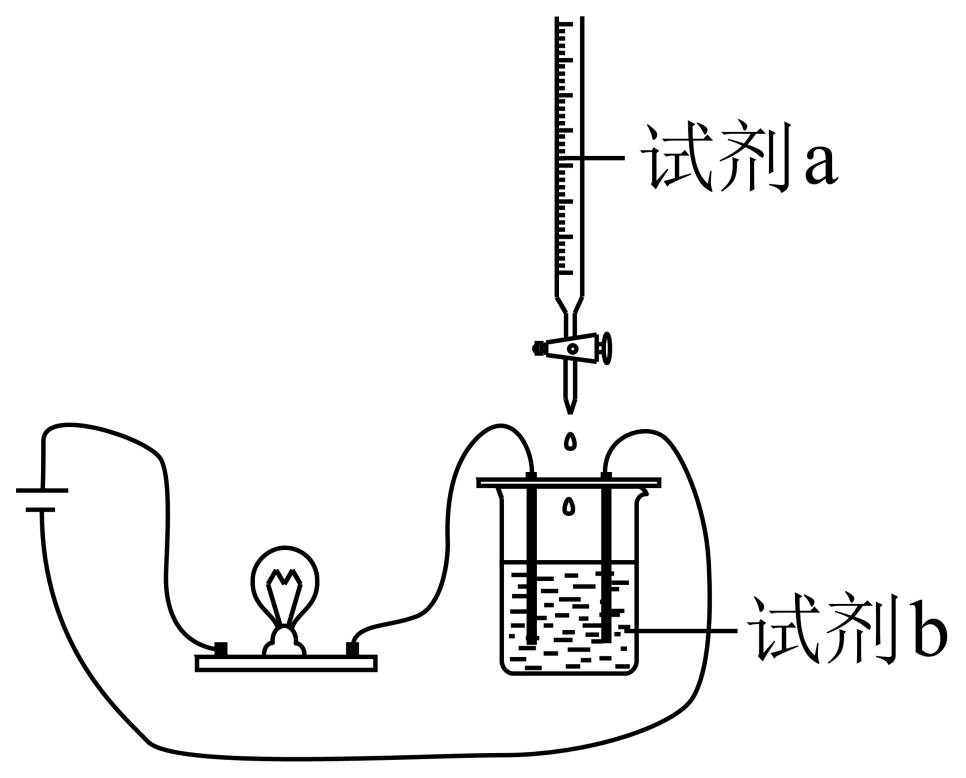
| $\rm A$ | $\rm B$ | $\rm C$ | $\rm D$ | |
| 试剂$\rm a$ | $\rm \text{NaHS}{{\text{O}}_{4}}$ | $\rm {{\text{H}}_{2}}\text{S}{{\text{O}}_{4}}$ | $\rm \text{CuS}{{\text{O}}_{4}}$ | $\rm \text{F}{{\text{e}}_{2}}{{\left( \text{S}{{\text{O}}_{4}} \right)}_{3}}$ |
| 试剂$\rm b$ | $\rm \text{Ba}{{\left( \text{OH} \right)}_{2}}$ | $\rm \text{Ba}{{\left( \text{OH} \right)}_{2}}$ | $\rm \text{Ba}{{\left( \text{OH} \right)}_{2}}$ | $\rm \text{Ba}{{\left( \text{OH} \right)}_{2}}$ |
$\\rm A$
","$\\rm B$
","$\\rm C$
","$\\rm D$
"]溶液导电性强弱与离子浓度成正比,实验时灯泡能出现由“亮$\rm →$灭$\rm →$亮”,说明在滴加溶液过程中导致离子浓度减小,最终为$\rm 0$,再继续滴加溶液,离子浓度逐渐增大,据此判断。
$\rm A$.向$\rm Ba(OH)_{2}$溶液中滴入$\text{NaHS}{{\text{O}}_{4}}$溶液,生成硫酸钡沉淀和水,化学方程式为:$\rm Ba(OH)_{2}+NaHSO_{4}=BaSO_{4\downarrow \rm }+H_{2}O+NaOH$或$\rm Ba(OH)_{2}+2NaHSO_{4}=BaSO_{4\downarrow \rm }+2H_{2}O+Na_{2}SO_{4}$,溶液中离子浓度不会为零,灯泡不会灭,$\rm A$符合题意;
$\rm B$.向$\rm Ba(OH)_{2}$溶液中滴入稀$\rm H_{2}SO_{4}$,生成硫酸钡沉淀和水,溶液中离子浓度逐渐减小,灯泡变暗,二者恰好反应时溶液的导电性几乎为零,灯泡熄灭,继续加硫酸,溶液的导电性又增强,灯泡又变亮,$\rm B$不符合题意;
$\rm C$.氢氧化钡为强电解质,硫酸铜溶液滴入$\rm Ba(OH)_{2}$溶液中,发生反应生成氢氧化铜和硫酸钡沉淀,溶液导电性减弱,过量后导电性增强,出现“亮$\rm →$暗(或灭)$\rm →$亮”现象,$\rm C$不符合题意;
$\rm D$.向$\rm Ba(OH)_{2}$溶液中滴入$\text{F}{{\text{e}}_{2}}{{\left( \text{S}{{\text{O}}_{4}} \right)}_{3}}$溶液,生成硫酸钡沉淀和氢氧化铁沉淀,溶液中离子浓度逐渐减小,灯泡变暗,二者恰好反应时溶液的导电性几乎为零,灯泡熄灭,继续加$\text{F}{{\text{e}}_{2}}{{\left( \text{S}{{\text{O}}_{4}} \right)}_{3}}$溶液,溶液的导电性又增强,灯泡又变亮,$\rm D$不符合题意。
故选:$\rm A$
| 导电的原因及条件题目答案及解析(完整版)
