| 导电的原因及条件 题目答案及解析
稿件来源:高途
| 导电的原因及条件题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第二节 离子反应
导电的原因及条件
回答下列问题。
现有下列$\rm 10$种物质均为钠或氯的单质及化合物:
①钠 ②熔融$\rm NaCl$ ③$\rm HClO$ ④$\rm ClO_{2}$ ⑤$\rm NaClO_{3}$晶体 ⑥漂白粉 ⑦过氧化钠 ⑧$\rm NaHCO_{3}$ ⑨盐酸 ⑩$\rm CCl_{4}$
上述物质中属于电解质的有 $\rm ($填序号,下同$\rm )$,非电解质有 ,能导电的有 。
②③⑤⑦⑧ ;④⑩ ;①②⑨
"]]电解质是溶于水或在熔融状态下能够导电的化合物;非电解质是溶于水或在熔融状态下不能够导电的化合物;溶液或熔融电解质导电的原因是存在自由移动的离子,金属导电的原因是存在自由移动的电子;上述物质中属于电解质的有②熔融$\rm NaCl$、③$\rm HClO$ 、⑤$\rm NaClO_{3}$晶体、⑦过氧化钠、⑧$\rm NaHCO_{3}$;非电解质有④$\rm ClO_{2}$、⑩$\rm CCl_{4}$;能导电的有①钠、②熔融$\rm NaCl$、⑨盐酸;
某兴趣小组的同学模拟侯德榜制碱法制取纯碱,流程如图。
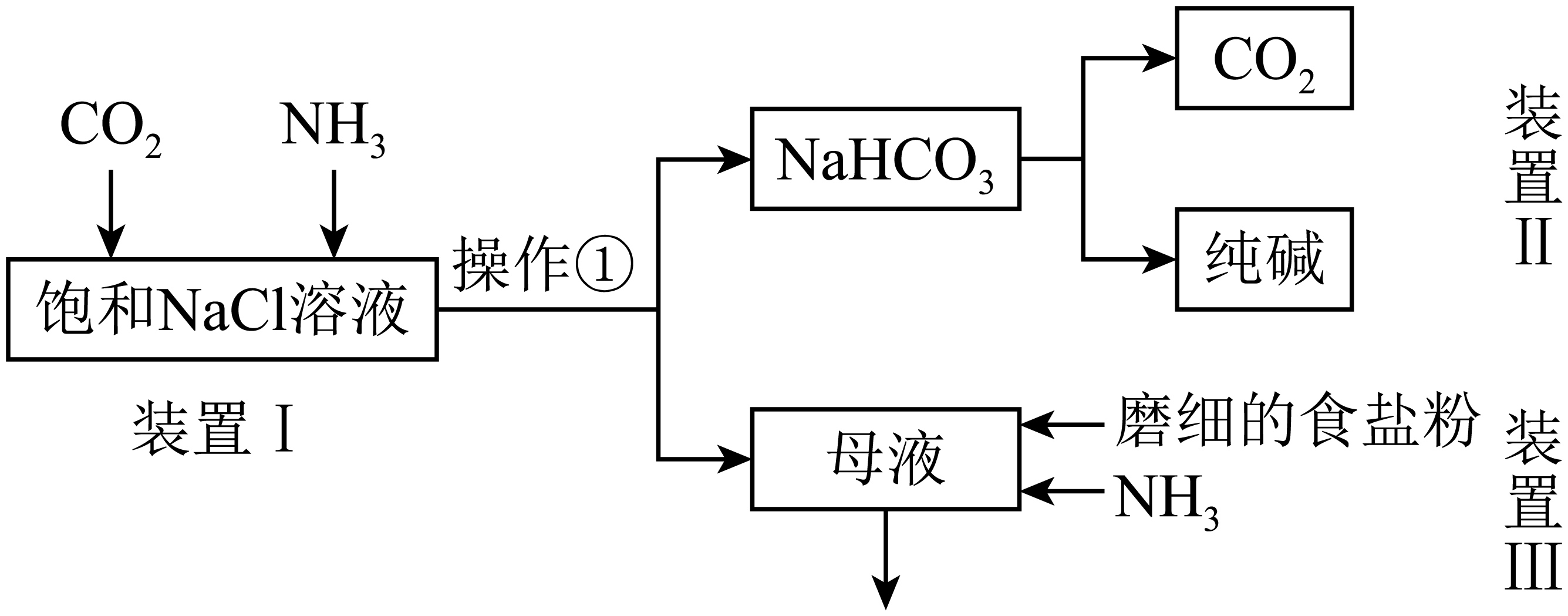
已知:几种盐的溶解度$\rm (25\;\rm ^\circ\rm C)$
| 物质 | $\rm NaCl$ | $\rm NH_{4}HCO_{3}$ | $\rm NaHCO_{3}$ | $\rm NH_{4}Cl$ |
| 溶解度$\rm /g$ | $\rm 36.0$ | $\rm 21.7$ | $\rm 9.6$ | $\rm 37.2$ |
①写出装置Ⅰ中反应的化学方程式 ,先通入装置Ⅰ气体是 。
②写出装置Ⅱ中发生反应的化学方程式 。
③该法生产的纯碱中可能含有$\rm Cl^{-}$,检验$\rm Cl^{-}$需要用到的试剂为 。
$\\rm NaCl+NH_{3}+CO_{2}+H_{2}O=NaHCO_{3}↓+NH_{4}Cl$; $\\rm NH_{3}$; $\\text{2NaHC}{{\\text{O}}_{\\text{3}}}\\begin{matrix} \\underline{\\underline{加热}} \\\\ {} \\\\ \\end{matrix}\\text{N}{{\\text{a}}_{\\text{2}}}\\text{C}{{\\text{O}}_{\\text{3}}}+{{\\text{H}}_{\\text{2}}}\\text{O+C}{{\\text{O}}_{\\text{2}}}\\uparrow $;硝酸银溶液和稀硝酸
"]]①装置Ⅰ中$\rm NaCl$、$\rm CO_{2}$、$\rm NH_{3}$、$\rm H_{2}O$发生反应生成$\rm NaHCO_{3}$和$\rm NH_{4}Cl$,反应的化学方程式为$\rm NaCl+NH_{3}+CO_{2}+H_{2}O=NaHCO_{3}↓+NH_{4}Cl$;先通入装置Ⅰ气体是氨气,氨气溶于水使得溶液显碱性,能吸收更多的二氧化碳;
②装置Ⅱ中发生反应为碳酸氢钠受热分解为碳酸钠和水、二氧化碳,化学方程式$\text{2NaHC}{{\text{O}}_{\text{3}}}\begin{matrix} \underline{\underline{加热}} \\ {} \\ \end{matrix}\text{N}{{\text{a}}_{\text{2}}}\text{C}{{\text{O}}_{\text{3}}}+{{\text{H}}_{\text{2}}}\text{O+C}{{\text{O}}_{\text{2}}}\uparrow $;
③氯离子和银离子生成不溶于酸的氯化银沉淀,稀硝酸可以排除溶液中其它杂质离子的干扰,故检验$\rm Cl^{-}$需要用到的试剂为硝酸银溶液和稀硝酸。
| 导电的原因及条件题目答案及解析(完整版)
