| 导电的原因及条件 题目答案及解析
稿件来源:高途
| 导电的原因及条件题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第二节 离子反应
导电的原因及条件
常温下,在两份相同的$\text{Ba}{{\left( \text{OH} \right)}_{2}}$溶液中,分别滴入单位体积$\text{SO}_{4}^{2-}$数目一样多的${{\text{H}}_{2}}\text{S}{{\text{O}}_{4}}$、$\text{NaHS}{{\text{O}}_{4}}$溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析说法正确的是$(\quad\ \ \ \ )$
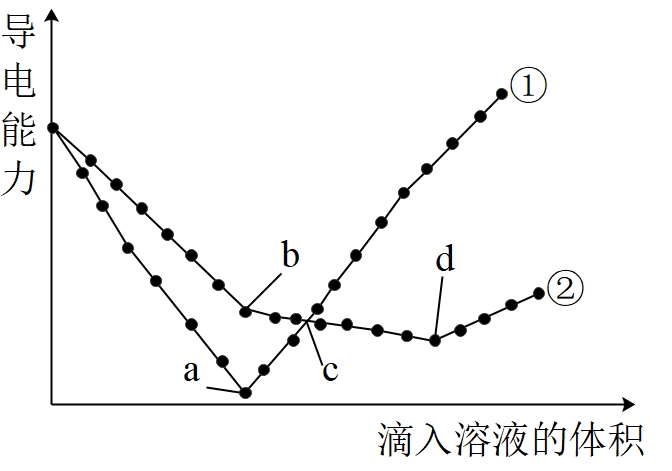
②代表滴加${{\\text{H}}_{2}}\\text{S}{{\\text{O}}_{4}}$溶液的溶液导电能力变化曲线
","$\\rm a$点溶液的导电能力强,说明$\\text{BaS}{{\\text{O}}_{\\text{4}}}$是非电解质
","向饱和石灰水中不断通入$\\text{C}{{\\text{O}}_{2}}$过程中溶液导电能力变化图像与上述①类似
","$\\rm bd$段对应的离子方程式是$\\text{B}{{\\text{a}}^{2+}}+{{\\text{H}}^{+}}+\\text{O}{{\\text{H}}^{-}}+\\text{SO}_{4}^{2-}=\\text{BaS}{{\\text{O}}_{4}}\\downarrow +{{\\text{H}}_{2}}\\text{O}$
"]分析:溶液或熔融电解质导电的原因是存在自由移动的离子,稀硫酸和氢氧化钡生成水和硫酸钡沉淀,溶液中离子浓度减小,导电性减弱,恰好反应时溶液中几乎不存在自由移动的离子,导电性为零,继续滴加稀硫酸,稀硫酸过量又存在自由移动的氢离子、硫酸根离子,溶液导电性增强;而氢氧化钡和硫酸氢钠反应溶液中一直存在钠离子,故溶液的导电性不会接近零,故曲线①为$\text{Ba}{{\left( \text{OH} \right)}_{2}}$溶液与${{\text{H}}_{2}}\text{S}{{\text{O}}_{4}}$的反应,则曲线②为$\text{Ba}{{\left( \text{OH} \right)}_{2}}$溶液与$\text{NaHS}{{\text{O}}_{4}}$溶液的反应;
$\rm A$.①代表滴加${{\text{H}}_{2}}\text{S}{{\text{O}}_{4}}$溶液的溶液导电能力变化曲线,$\rm A$错误;
$\rm B$.$\rm a$点溶液的导电能力最弱,说明溶液中所含离子浓度较低,其原因是$\rm BaSO_{4}$难溶于水,不能据此判断$\rm BaSO_{4}$是否属于非电解质,$\rm B$错误;
$\rm C$.向饱和石灰水中不断通入$\rm CO_{2}$,二者反应生成难溶物$\rm CaCO_{3}$和$\rm H_{2}O$,溶液中离子浓度减小,随后$\rm CaCO_{3}$和$\rm H_{2}O$、$\rm CO_{2}$反应产生碳酸氢钙溶液,离子浓度逐渐增大,溶液导电性逐渐增强,电导率变化图像与上述①类似,$\rm C$正确;
$\rm D$.$\rm a$点${{\text{H}}_{2}}\text{S}{{\text{O}}_{4}}$与$\text{Ba}{{\left( \text{OH} \right)}_{2}}$恰好完全反应,$\rm Ba^{2+}$完全沉淀,因此$\rm b$点$\rm Ba^{2+}$恰好反应完全,溶液中$\rm OH^{-}$恰好反应一半,因此$\rm bd$段为$\rm H^{+}$与$\rm OH^{-}$反应,反应离子方程式为$\rm H^{+}+OH^{-}=H_{2}O$,$\rm D$错误;
故选:$\rm C$
| 导电的原因及条件题目答案及解析(完整版)
