高中 | 原电池工作原理 题目答案及解析
稿件来源:高途
高中 | 原电池工作原理题目答案及解析如下,仅供参考!
选修四
第四章 电化学基础
第一节 原电池
原电池工作原理
反电渗析法盐差电池是用离子交换膜将海水与河水隔开$\rm ($离子浓度:海水$\rm \gt $河水$\rm )$,阴阳离子在溶液中定向移动将盐差能转化为电能的电池,原理如图所示。
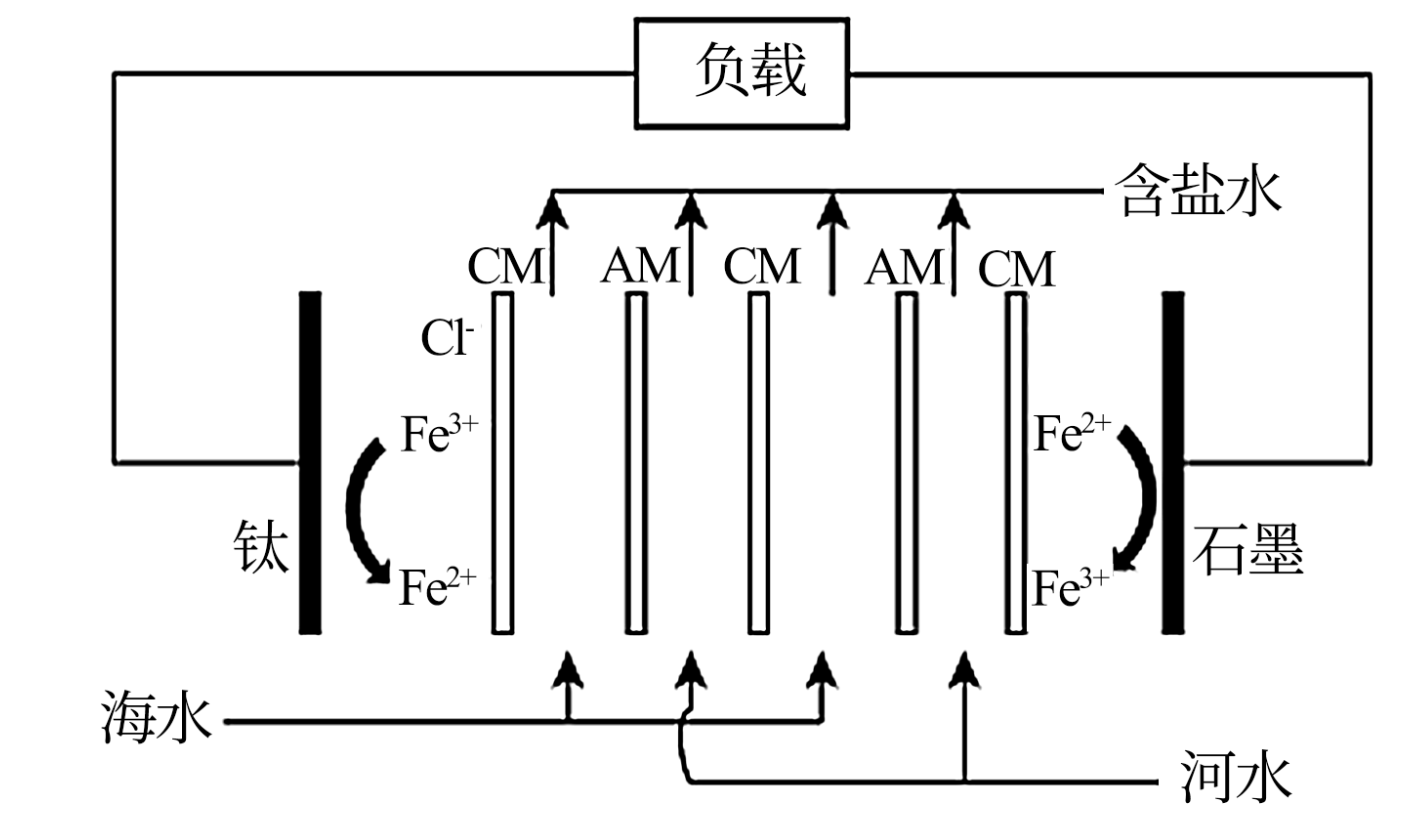
下列说法不正确的是$(\quad\ \ \ \ )$
["
钛电极上发生还原反应
","石墨极上的反应为:$\\rm Fe^{2+}-e^{-}=Fe^{3+}$
","石墨极为电池的负极
","$\\rm CM$膜为阴离子交换膜
"][["D"]]
$\rm A$.根据图中信息在钛电极上是铁离子得到电子变为亚铁离子,化合价降低,发生还原反应,故$\rm A$正确;
$\rm B$.根据图中信息在石墨极上是亚铁离子失去电子变为铁离子,其电极反应式为:$\rm Fe^{2+}-e^{-}=Fe^{3+}$,故$\rm B$正确;
$\rm C$.石墨极上是亚铁离子失去电子变为铁离子,因此石墨极为电池的负极,故$\rm C$正确;
$\rm D$.根据原电池中“同性相吸”,钛为正极,因此$\rm CM$膜为阳离子交换膜,阳离子穿过阳离子交换膜向正极移动,故$\rm D$错误。
故选:$\rm D$
高中 | 原电池工作原理题目答案及解析(完整版)
去刷题
今日推荐 ![]()
![]()
![]()
