| 化学平衡常数 题目答案及解析
稿件来源:高途
| 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
$\rm ($一$\rm )$某同学在实验室研究锌与酸的反应,实验数据如下:
| 实验序号 | 锌质量 | 锌状态 | $c\left( {{\text{H}}_{\text{2}}}\text{S}{{\text{O}}_{4}} \right)$ | $\rm V(H_{2}SO_{4})$ | 金属消失时间 |
| $\rm 1$ | $\rm 0.10$ $\rm g$ | 颗粒 | $\rm 0.5$ $\rm mol/L$ | $\rm 50\;\rm mL$ | $\rm 500$ $\rm s$ |
| $\rm 2$ | $\rm 0.10$ $\rm g$ | 粉末 | $\rm 0.5$ $\rm mol·L^{-1}$ | $\rm 50\;\rm mL$ | $\rm 50$ $\rm s$ |
| $\rm 3$ | $a\text{ g}$ | 颗粒 | $\rm 1.0$ $\rm mol·L^{-1}$ | $\rm 50\;\rm mL$ | $\rm 125$ $\rm s$ |
分析上述数据,回答下列问题
实验$\rm 1$和$\rm 2$表明, 对反应速率有影响。
固体的接触面积$\\rm ($表面积$\\rm )$
"]]实验$\rm 1$和$\rm 2$中,$\rm H_{2}SO_{4}$溶液的浓度和体积都相同,锌的质量相同,只是颗粒大小不同,反应所用的时间不同,由此表明,固体的接触面积$\rm ($表面积$\rm )$对反应速率有影响。
实验$\rm 1$和$\rm 3$研究的是反应物浓度对反应速率的影响,则$a=$ $\rm \;\rm g$,实验$\rm 3$金属消失所用的时间比实验$\rm 1$要短,请用有效碰撞理论加以解释 。
$\\rm 0.10$ ; 在其他条件相同时,增大反应物的浓度,单位体积内活化分子数增加,有效碰撞次数增加,反应速率增大
"]]实验$\rm 1$和$\rm 3$研究的是反应物浓度对反应速率的影响,则锌的质量、颗粒大小都应相同,$a=0.10\,\text{g}$;实验$\rm 3$金属消失所用的时间比实验$\rm 1$要短,则表明有效碰撞的次数多,其解释为:在其他条件相同时,增大反应物的浓度,单位体积内活化分子数增加,有效碰撞次数增加,反应速率增大。
该同学研究发现:相同的锌粒分别与$\rm H_{2}SO_{4}$、盐酸反应$\rm ($操作如下图$\rm )$,现象差异明显$\rm ($稀盐酸中锌表面产生气泡的速率要比稀硫酸快$\rm )$。该同学对产生这一现象的原因,提出两种假设:
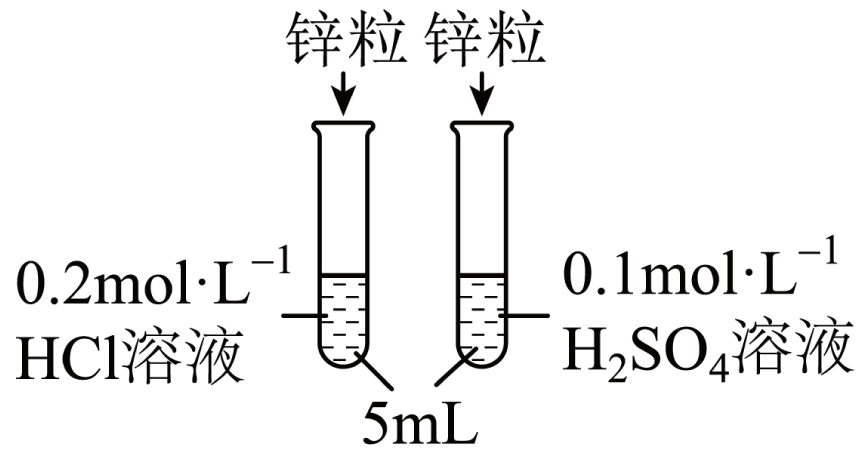
$\rm a$.氯离子对反应起促进作用,加快了反应的进行;
$\rm b$. ,减缓了反应的进行。
为进一步证实猜想$b$,该同学在室温下,分别取$\rm 5$ $\rm mL$ $\rm 0.2$ $\rm mol·L^{-1}$盐酸溶液于两支试管中,一份加入一定量的固体 $\rm ($填“所加试剂化学式”$\rm )$,另一份作对比实验,再分别同时加入完全相同的锌粒,比较反应速率的大小。
硫酸根离子对反应起抑制作用 ; $\\rm Na_{2}SO_{4}$或$\\rm K_{2}SO_{4}$或$\\rm (NH_{4})_{2}SO_{4}$
"]]$\rm a$.氯离子对反应起促进作用,加快了反应的进行;
$\rm b$.硫酸根离子对反应起抑制作用,减缓了反应的进行。
为进一步证实猜想$b$,该同学在室温下,分别取$\rm 5$ $\rm mL$ $\rm 0.2$ $\rm mol·L^{-1}$盐酸溶液于两支试管中,一份加入一定量的含硫酸根离子的固体,可以是$\rm Na_{2}SO_{4}$或$\rm K_{2}SO_{4}$或$\rm (NH_{4})_{2}SO_{4}$,另一份作对比实验,再分别同时加入完全相同的锌粒,比较反应速率的大小。
锌粒和稀硫酸反应制取氢气时,往往加入少量$\rm CuSO_{4}$粉末,可加快产生$\rm H_{2}$的速率,其原因是 $\rm ($结合化学方程式作出合理解释$\rm )$。
$\\rm Zn+CuSO_{4}=ZnSO_{4}+Cu$,铜、锌和稀硫酸构成原电池,加快反应速率
"]]锌粒和稀硫酸反应制取氢气时,往往加入少量$\rm CuSO_{4}$粉末,发生反应生成的$\rm Cu$与$\rm Zn$、稀硫酸构成原电池,发生原电池反应,可加快产生$\rm H_{2}$的速率,其原因是:$\rm Zn+CuSO_{4}=ZnSO_{4}+Cu$,铜、锌和稀硫酸构成原电池,加快反应速率。
$\rm ($二$\rm )$在一定体积的密闭容器中,进行如下化学反应: $\text{C}{{\text{O}}_{\text{2}}}\left( \text{g} \right)+{{\text{H}}_{\text{2}}}\left( \text{g} \right)\rightleftharpoons \text{CO}\left( \text{g} \right)+{{\text{H}}_{\text{2}}}\text{O}\left( \text{g} \right)$,其化学平衡常数$K$与温度$t$的关系如下:
| $t\text{ }{}^\circ \text{C}$ | $\rm 700$ | $\rm 800$ | $\rm 830$ | $\rm 1000$ | $\rm 1200$ |
| $K$ | $\rm 0.6$ | $\rm 0.9$ | $\rm 1.0$ | $\rm 1.7$ | $\rm 2.6$ |
请回答下列问题:
该反应为 反应$\rm ($填“吸热”或“放热”$\rm )$。
吸热
"]]从表中数据可以看出,升高温度,$K$值增大,则平衡正向移动,该反应为吸热反应。
$\rm 800\;\rm ^\circ\rm C$,固定容积的密闭容器中,放入混合物,起始浓度为$c\left( \text{CO} \right)=0.01\text{ mol/L}$,$c\left( {{\text{H}}_{\text{2}}}\text{O} \right)=0.03\text{ mol/L}$,$c\left( \text{C}{{\text{O}}_{2}} \right)=0.01\,\text{mol/L}$,$c\left( {{\text{H}}_{2}} \right)=0.05\,\text{mol/L}$,则反应开始时,$\rm H_{2}O$的消耗速率比生成速率 $\rm ($填“大”、“小”或“不能确定”$\rm )$。
小
"]]$\rm 800\;\rm ^\circ\rm C$,固定容积的密闭容器中,放入混合物,起始浓度为$c\left( \text{CO} \right)=0.01\text{ mol/L}$,$c\left( {{\text{H}}_{\text{2}}}\text{O} \right)=0.03\text{ mol/L}$,$c\left( \text{C}{{\text{O}}_{2}} \right)=0.01\,\text{mol/L}$,$c\left( {{\text{H}}_{2}} \right)=0.05\,\text{mol/L}$, ${{Q}_{\text{c}}}=\dfrac{0.01\times 0.03}{0.01\times 0.05}\rm =0.6\lt 0.9$,则反应开始时,平衡正向移动,$\rm H_{2}O$的消耗速率比生成速率小。
| 化学平衡常数题目答案及解析(完整版)
