高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
亚氯酸钠$\rm (NaClO_{2})$是一种高效漂白剂,在酸性条件下生成$\rm NaCl$并放出$\rm ClO_{2}$气体,$\rm ClO_{2}$有类似$\rm Cl_{2}$的性质。某化学兴趣小组探究$\rm NaClO_{2}$的制备与性质,装置如图所示。
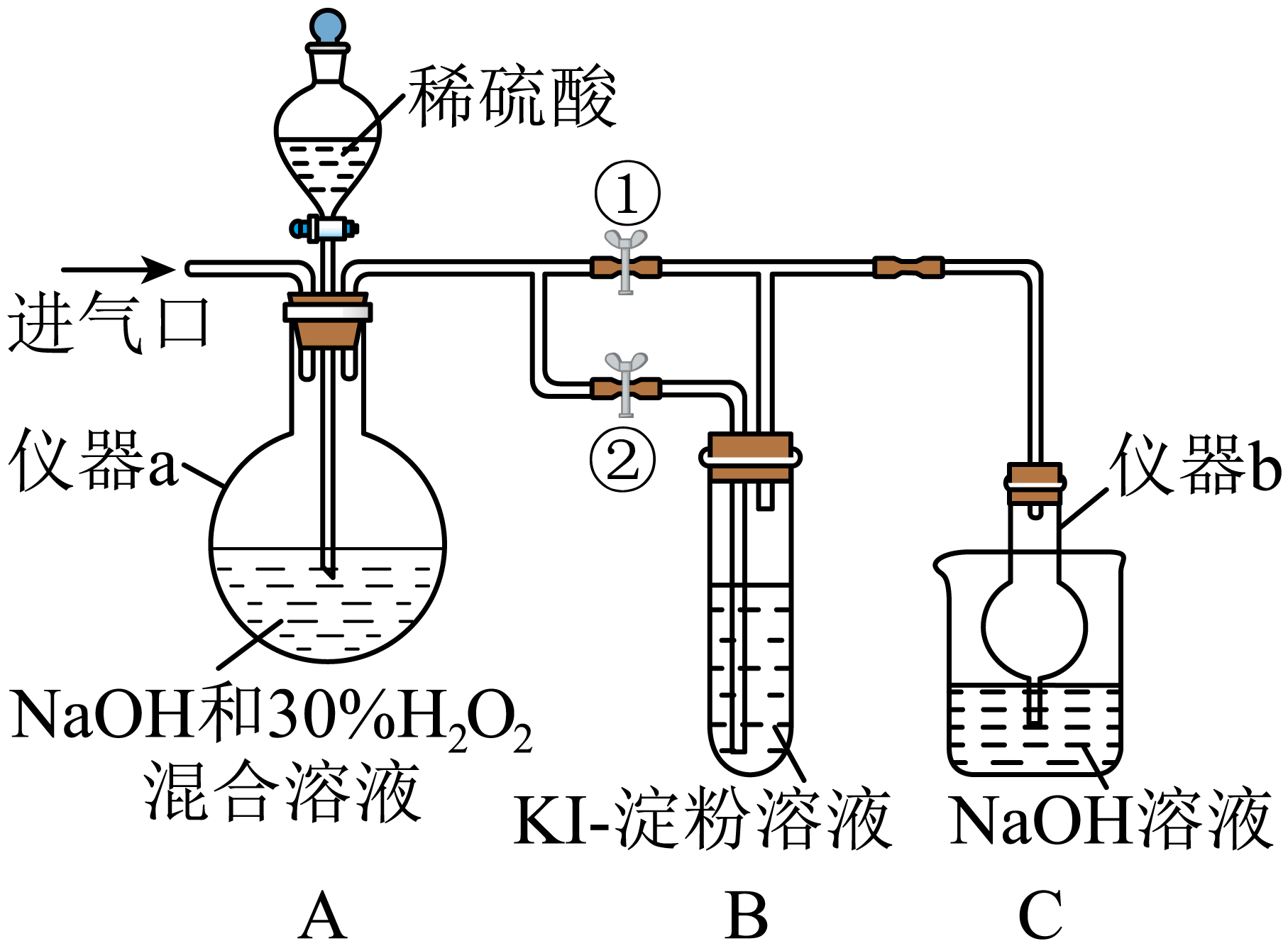
请回答下列问题:
$\rm I$.制备亚氯酸钠。
关闭止水夹②,打开止水夹①,从进气口通入足量$\rm ClO_{2}$,充分反应$\rm ($该反应放出大量的热$\rm )$。
仪器$a$的名称为 ,仪器$b$的作用是 。
圆底烧瓶 ; 防止倒吸
"]]根据图中信息得到仪器$a$的名称为圆底烧瓶,氯气和$\rm NaOH$溶液易发硬,容易发生倒吸,因此仪器$b$的作用是防止倒吸;
装置$\rm A$中生成$\rm NaClO_{2}$,反应的离子方程式为 。
$\\rm 2ClO_{2}+2OH^{-}+H_{2}O_{2}=2ClO_{2}^{-}\\rm +2H_{2}O+O_{2}↑$
"]]装置$\rm A$中是$\rm ClO_{2}$、$\rm NaOH$和$\rm H_{2}O_{2}$反应生成$\rm NaClO_{2}$、$\rm H_{2}O$和$\rm O_{2}$,其离子方程式为$\rm 2ClO_{2}+2OH^{-}+H_{2}O_{2}=2ClO_{2}^{-}\rm +2H_{2}O+O_{2}↑$;
实际反应中发现消耗的$\rm NaOH$比理论值偏少,原因可能是 。
反应放出的热量使温度升高导致$\\rm H_{2}O_{2}$分解,导致$\\rm ClO_{2}$反应的物质的量减少,因而其反应消耗的$\\rm NaOH$比理论值偏少
"]]实际反应中发现消耗的$\rm NaOH$比理论值偏少,原因可能是反应放出的热量使温度升高导致$\rm H_{2}O_{2}$分解,导致$\rm ClO_{2}$反应的物质的量减少,因而其反应消耗的$\rm NaOH$比理论值偏少。
Ⅱ$\rm .$探究亚氯酸钠的性质。
停止通入$\rm ClO_{2}$气体,再通入空气一段时间后,关闭止水夹①,打开止水夹②,向$\rm A$中滴入稀硫酸。
已知:催化剂会加快反应的进行。$\rm A$中反应开始时很缓慢,稍后产生气体的速率急剧加快。反应急剧加快的可能原因是 。
$\\rm NaClO_{2}$与$\\rm H_{2}SO_{4}$反应生成的$\\rm Cl^{-}$对反应起催化作用,导致反应速率加快
"]]开始时$\rm A$中反应缓慢,稍后产生气体的速率急剧加快。反应急剧加快的可能原因是$\rm NaClO_{2}$与$\rm H_{2}SO_{4}$反应生成的$\rm Cl^{-}$对反应起催化作用,导致反应速率加快。
实验过程中,$\rm B$中酸化的$\rm KI$淀粉溶液变蓝色,产生该现象的离子方程式为 。
$2\\text{C}1{{\\text{O}}_{2}}+10{{\\text{I}}^{-}}+8{{\\text{H}}^{+}}=2\\text{C}{{\\text{l}}^{-}}+5{{\\text{I}}_{2}}+4{{\\text{H}}_{2}}\\text{O}$
"]]实验过程中,$\rm B$中酸化的$\rm KI$淀粉溶液变蓝色,是由于在酸性条件下,$\rm ClO_{2}$、$\rm KI$发生氧化还原反应产生$\rm I_{2}$,$\rm I_{2}$遇淀粉溶液变为蓝色,该反应的离子方程式为:$2\text{C}1{{\text{O}}_{2}}+10{{\text{I}}^{-}}+8{{\text{H}}^{+}}=2\text{C}{{\text{l}}^{-}}+5{{\text{I}}_{2}}+4{{\text{H}}_{2}}\text{O}$。
$\rm NaClO_{2}$和$\rm Cl_{2}$消毒时,还原产物均为$\rm Cl^{-}$。消毒剂的消毒效率可用单位质量消毒剂被还原时得电子数表示,计算$\rm NaClO_{2}$的消毒效率是$\rm Cl_{2}$的 倍$\rm ($计算结果保留一位小数$\rm )$。
$\\rm 1.6$
"]]$\rm NaClO_{2}$和$\rm Cl_{2}$消毒时,还原产物均为$\rm Cl^{-}$。消毒剂的消毒效率可用单位质量消毒剂被还原时得电子数表示,$\rm NaClO_{2}$的消毒效率是$\dfrac{\text{4}\,\text{mol}}{\text{90}\text{.5}\,\text{g}}$;$\rm Cl_{2}$的消毒效率是$\dfrac{2\,\text{mol}}{71\,\text{g}}$,因此消毒效率的比$\dfrac{\dfrac{4\,\text{mol}}{90.5\,\text{g}}}{\dfrac{2\,\text{mol}}{71\,\text{g}}}=1.6$。
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
