高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
工业上常用$\rm NaClO$氧化法生产高铁酸钾$\rm (K_{2}FeO_{4})$,其主要生产流程如图:
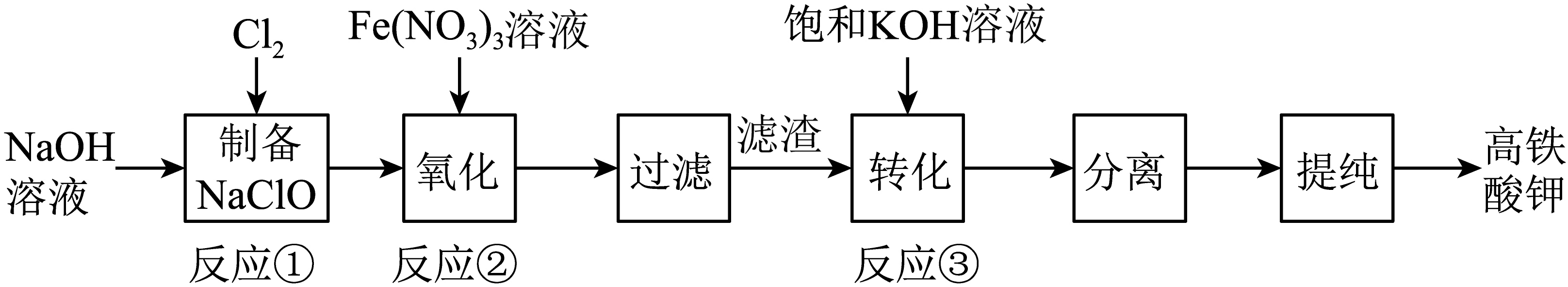
已知:
$\rm I$.$\rm Cl_{2}$和$\rm NaOH$溶液在常温下反应可以制得漂白液,当温度高于$\rm 70\;\rm ^\circ\rm C$时可以反应生成$\rm NaClO_{3}$;
Ⅱ$\rm .K_{2}FeO_{4}$在温度低于$\rm 198\;\rm ^\circ\rm C$或强碱性条件下相当稳定,其稳定性随$\rm pH$减小而降低,其氧化性随$\rm pH$减小而逐渐显现;
Ⅲ$\rm .K_{2}FeO_{4}$不溶于乙醚、乙醇等有机溶剂,是一种高效多功能新型非氯绿色消毒剂,主要用于饮用水处理。
基态$\rm Fe$原子的简化的电子排布式为 ,铁元素位于元素周期表的 区。
$\\rm [Ar]3d^{6}4s^{2}$;$\\rm d$
"]]基态$\rm Fe$原子的电子排布式为$\rm 1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}3d^{6}4s^{2}$,其简化的电子排布式为$\rm [Ar]3d^{6}4s^{2}$,铁元素最后排布的电子位于$\rm 3d$轨道,则属于元素周期表的$\rm d$区。
写出温度高于$\rm 70\;\rm ^\circ\rm C$时氯气和$\rm NaOH$发生反应的离子方程式: 。
$3\\text{C}{{\\text{l}}_{2}}+6\\text{O}{{\\text{H}}^{-}}=\\text{ClO}_{3}^{-}+5\\text{C}{{\\text{l}}^{-}}+3{{\\text{H}}_{2}}\\text{O}$
"]]温度高于$\rm 70\;\rm ^\circ\rm C$时氯气和$\rm NaOH$发生反应,生成$\rm NaClO_{3}$、$\rm NaCl$等,离子方程式:$3\text{C}{{\text{l}}_{2}}+6\text{O}{{\text{H}}^{-}}=\text{ClO}_{3}^{-}+5\text{C}{{\text{l}}^{-}}+3{{\text{H}}_{2}}\text{O}$。
写出反应③的化学方程式: 。
$\\text{N}{{\\text{a}}_{2}}\\text{Fe}{{\\text{O}}_{4}}+2\\text{KOH}={{\\text{K}}_{2}}\\text{Fe}{{\\text{O}}_{4}}\\downarrow +2\\text{NaOH}$
"]]反应③中,$\rm Na_{2}FeO_{4}$与$\rm KOH$发生复分解反应,$\rm Na_{2}FeO_{4}$转化为溶解度较小的$\rm K_{2}FeO_{4}$,化学方程式:$\text{N}{{\text{a}}_{2}}\text{Fe}{{\text{O}}_{4}}+2\text{KOH}={{\text{K}}_{2}}\text{Fe}{{\text{O}}_{4}}\downarrow +2\text{NaOH}$。
提纯高铁酸钾固体时,过滤需要用到的硅酸盐仪器主要有 ,过滤后最好用 洗涤滤渣,得到高纯度产品。
烧杯、漏斗、玻璃棒;乙醇或乙醚
"]]提纯高铁酸钾固体时,过滤需要用到的硅酸盐仪器主要有:烧杯、漏斗、玻璃棒;$\rm K_{2}FeO_{4}$不溶于乙醚、乙醇等有机溶剂,则过滤后最好用乙醇或乙醚洗涤滤渣,得到高纯度产品。
实验室也可以用氯气与$\rm Fe(OH)_{3}$在氢氧化钾溶液中反应制备少量$\rm K_{2}FeO_{4}$,写出该反应的离子方程式 ,该反应中每制得$\rm 2\;\rm mol\;\rm K_{2}FeO_{4}$,消耗的氯气在标准状况下的体积为 $\rm \;\rm L$;在高铁酸钾溶液中滴加盐酸,有黄绿色气体产生,原因是 $\rm ($用文字描述$\rm )$。
$3\\text{C}{{\\text{l}}_{2}}+2\\text{Fe}{{\\left( \\text{OH} \\right)}_{3}}+10\\text{O}{{\\text{H}}^{-}}=2\\text{FeO}_{\\text{4}}^{2-}+6\\text{C}{{\\text{l}}^{-}}+8{{\\text{H}}_{2}}\\text{O}$;$\\rm 67.2$;随着盐酸加入,溶液$\\rm pH$减小,高铁酸钾氧化性增强,氧化$\\rm Cl^{-}$生成$\\rm Cl_{2}$
"]]实验室也可以用氯气与$\rm Fe(OH)_{3}$在氢氧化钾溶液中反应制备少量$\rm K_{2}FeO_{4}$,该反应的离子方程式为$3\text{C}{{\text{l}}_{2}}+2\text{Fe}{{\left( \text{OH} \right)}_{3}}+10\text{O}{{\text{H}}^{-}}=2\text{FeO}_{\text{4}}^{2-}+6\text{C}{{\text{l}}^{-}}+8{{\text{H}}_{2}}\text{O}$。由反应可建立关系式:$\rm 3Cl_{2}-2 K_{2}FeO_{4}$,该反应中每制得$\rm 2\;\rm mol\;\rm K_{2}FeO_{4}$,消耗的氯气的物质的量为$\rm 3\;\rm mol$,在标准状况下的体积为$\rm 3\;\rm mol\times 22.4\;\rm L/mol=67.2\;\rm L$;在高铁酸钾溶液中滴加盐酸,有黄绿色气体产生,则在酸性较强溶液中,高铁酸钾能将$\rm Cl^{-}$氧化为$\rm Cl_{2}$,原因是:随着盐酸加入,溶液$\rm pH$减小,高铁酸钾氧化性增强,氧化$\rm Cl^{-}$生成$\rm Cl_{2}$。
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
