高中 | 原电池工作原理 题目答案及解析
稿件来源:高途
高中 | 原电池工作原理题目答案及解析如下,仅供参考!
选修四
第四章 电化学基础
第一节 原电池
原电池工作原理
铜$\rm —$锌原电池装置如图所示,电解质溶液为硫酸铜溶液,电池工作一段时间后,下列说法错误的是$(\qquad)$
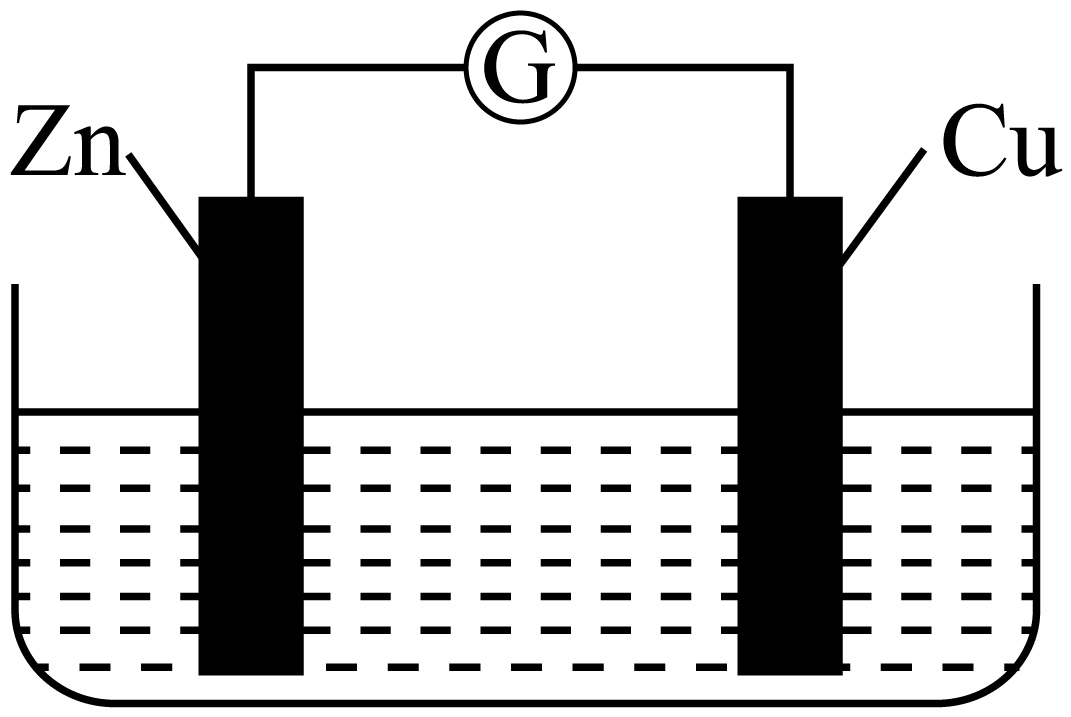
["
锌电极上的反应为$\\rm Zn-2e-=Zn^{2+}$
","溶液中的$\\text{SO}_{\\text{4}}^{\\text{2-}}$向铜电极移动
","电子从锌电极经过硫酸铜溶液流向铜电极
","铜电极质量增加
"][["BC"]]
锌铜原电池中$\rm Zn$做负极,是电子生成$\rm Zn^{2+}$,铜做正极,电解质中$\rm Cu^{2+}$得电子生成$\rm Cu$;
$\rm A$.锌的活动性强于铜,锌作负极,则锌电极上的反应为$\rm Zn-2e^{-}=Zn^{2+}$,$\rm A$正确;
$\rm B$.原电池工作时,电解质溶液中的阴离子向负极移动,故$\text{SO}_{\text{4}}^{\text{2-}}$向锌电极移动,$\rm B$错误;
$\rm C$.电子从锌电极经过导线流向铜电极,溶液不能传导电子,$\rm C$错误;
$\rm D$.铜电极是正极,溶液中的铜离子在正极放电析出铜,因此铜电极质量增加,$\rm D$正确;
故选:$\rm BC$
高中 | 原电池工作原理题目答案及解析(完整版)
去刷题
今日推荐 ![]()
![]()
![]()
